机构名称:
¥ 3.0
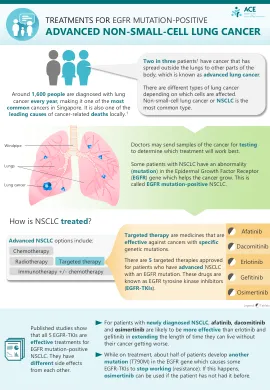
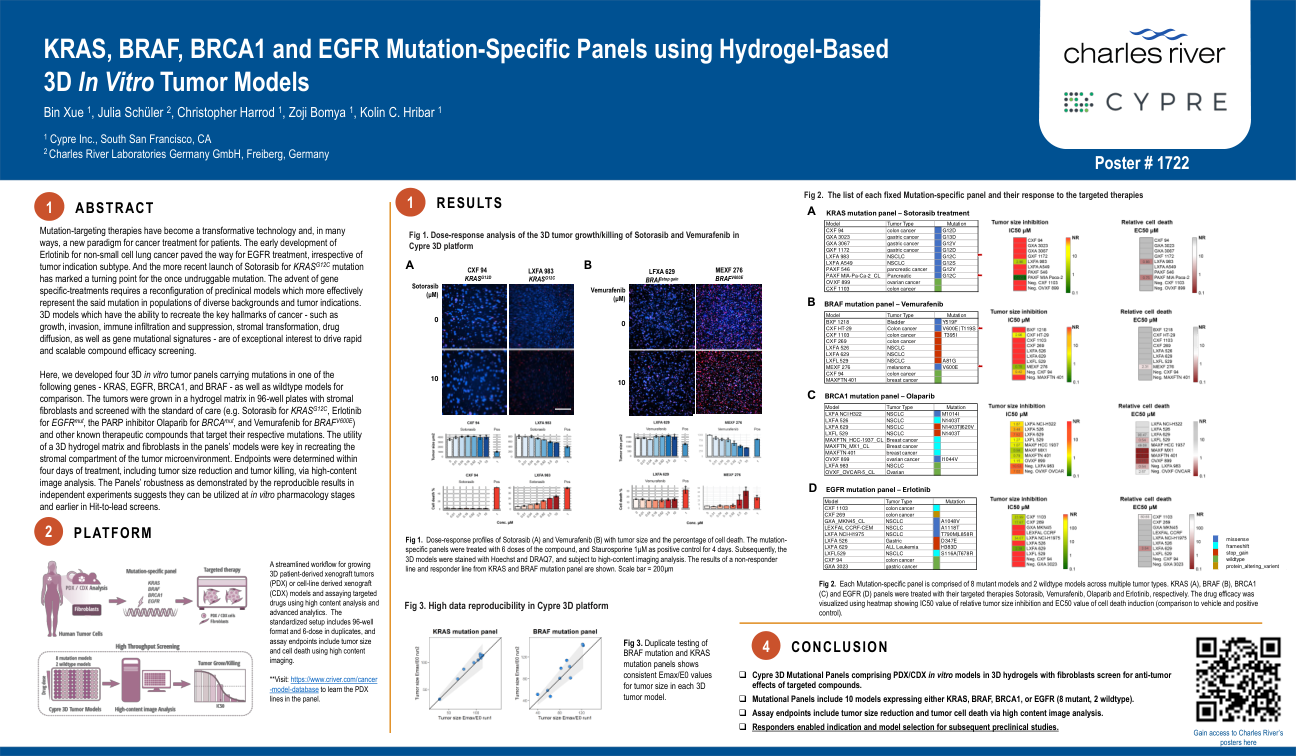
由于缺乏明确且具有成本效益的治疗靶点,肝细胞癌 (HCC) 是世界上最危险的疾病之一。目前,传统化疗药物的毒性和多药耐药性的产生正在推动靶向治疗的研究。纳米生物医学领域开发有效的治疗性纳米药物输送系统的潜力被视为封装和释放多种抗癌疗法的重要制药趋势。在这方面,当前的研究集中在创建可生物降解的壳聚糖纳米颗粒 (CSNP),以选择性和持续释放蜂毒到肝癌细胞中。此外,用聚乙二醇 (PEG) 和 GE11 肽偶联的蜂毒-CSNP 进行表面改性可以靶向 EGFR 过表达的肝癌细胞。一系列体外和体内细胞分析被用于研究靶向蜂毒-CSNP 的抗肿瘤作用和机制。尤其是靶向蜂毒-CSNPs,研究发现其对 HepG2 细胞的细胞毒性比对 SMMC-7721 细胞的细胞毒性更高,细胞摄取更强,细胞迁移显著减少,从而改善癌症抑制。与天然蜂毒相比,它还通过增强活性氧、激活线粒体依赖性途径、抑制 EGFR 刺激的 MEK/ERK 途径和升高 p38-MAPK 来促进 EGFR 过表达 HepG2 细胞中的癌细胞死亡。在肝细胞癌 (HCC) 诱发的小鼠中,它对肿瘤组织具有抗癌特性。它还可以改善肝功能和结构,而不会引起任何明显的毒副作用,并通过激活凋亡途径抑制肿瘤生长。这种针对癌症的纳米粒子的设计确立了 GE11-蜂毒-CSNPs 作为 EGFR 过度表达恶性肿瘤的潜在化疗治疗方法。最后,我们的工作阐明了靶向蜂毒-CSNPs 抗癌选择性的分子机制,并概述了针对肝癌的治疗策略。
载有蜜蜂毒液的 EGFR 靶向肽
主要关键词