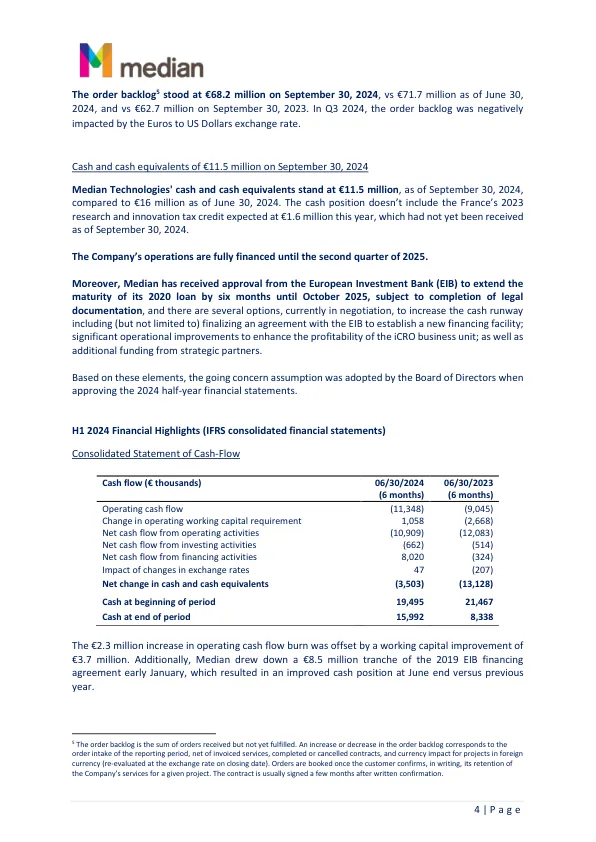
eyonis™ LCS SaMD:继关键研究取得重大进展后,计划于 2025 年上半年提交监管申请以获得营销授权、FDA 510(k) 批准和 CE 标志。公司于 8 月发布了 REALITY(Clinicaltrials.gov 标识符:NCT06576232)的明确积极结果,这是两项关键 eyonis™ LCS 临床研究中的第一项,评估了 eyonis™ LCS 在准确诊断肺癌方面的独立性能。尽管包含了许多具有挑战性的低剂量计算机断层扫描 (LDCT) 图像,eyonis™ LCS SaMD 仍取得了卓越的成果,并具有统计学意义地满足了所有主要和次要终点。eyonis™ LCS 在患者水平上实现了 0.904 的曲线下面积 (AUC) 值,而 AUC 为 0.80 – 这是 REALITY 的主要终点的最小值。 REALITY 的积极结果尤其令人印象深刻地展示了 Median SaMD 的 AI 能力,因为参与研究的机构在研究期间提供了异常具有挑战性的患者数据。与普通患者群体相比,REALITY 的数据丰富,包括小型无毛刺癌症和大型毛刺良性结节,这两种情况对于放射科医生来说都很难在现实环境中进行诊断,因为没有任何强大的计算机辅助诊断系统。研究中包含的 80% 分期 LDCT 图像被提供这些图像的机构认为是难以诊断的 1 期癌症。eyonis™ LCS 的 REALITY 分析基于美国和欧洲五大癌症中心和两家临床数据提供商提供的 1,147 名患者的数据。 2024 年 11 月 7 日将举行网络直播,包括参与 REALITY 研究的国际知名关键意见领袖,讨论这些数据对于像他们一样在临床实践中经常治疗肺癌患者的肺科医生意味着什么。具体邀请将很快发布。第二项关键试验 RELIVE 是一项多读者多病例 (MRMC) 研究,将提供 eyonis™ LCS 的临床验证,以补充已经通过 REALITY 获得的分析验证。RELIVE 研究的目标是比较放射科医生在有或没有 eyonis™ LCS 帮助的情况下成功诊断肺癌患者的能力。 RELIVE 正在进行中,计划在未来几个月内完成,预计在 2025 年第一季度读取数据。Median Technologies 预计将于 2025 年上半年在美国提交 eyonis™ LCS FDA 510(k) 审批的监管文件,并在欧洲提交 CE 标志的监管文件。此外,该公司正在准备健康经济研究,以证明 eyonis™ LCS SaMD 具有显著的生命和成本节约优势,预计这将大力支持美国和欧洲付款人的报销。Median 还正在积极与各种潜在的地区和全球分销合作伙伴进行讨论,为主要在美国实现 eyonis™ LCS 的商业化做准备。
Median Technologies 报告 2024 年第三季度运营和财务更新
主要关键词