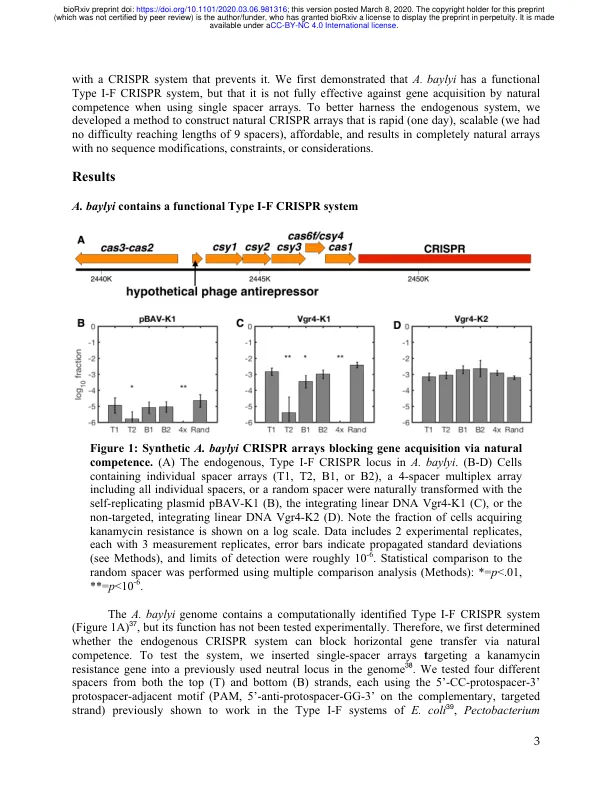
摘要 CRISPR-Cas 系统是一种原核免疫系统,不仅在细菌和古细菌中广泛增殖,而且最近在人类生物学研究和应用中也广泛存在。迄今为止,许多工作都利用了合成的 sgRNA 和 CRISPR 核酸酶 Cas9,但阵列处理核酸酶的发现现在允许在异源宿主以及具有内源系统的生物体中使用更紧凑、天然的 CRISPR 阵列。不幸的是,多重天然 CRISPR 阵列的构建在技术上仍然具有挑战性、成本高昂和/或耗时。这种限制阻碍了在天然和异源宿主中涉及天然 CRISPR 阵列的研究。为了解决这个问题,我们提出了一种组装 CRISPR 阵列的方法,这种方法简单、快速、经济实惠且高度可扩展——我们用一天的工作组装了 9 间隔阵列。我们利用这种方法来利用高能力细菌 Acinetobacter baylyi 的内源性 CRISPR 系统,结果表明虽然单个间隔区并不总是能够完全有效地阻止通过天然能力获取 DNA,但多重天然 CRISPR 阵列可以实现几乎完全的 DNA 排除和基因组编辑,包括两者的多个靶标。除了展示一种将使各种应用受益的 CRISPR 阵列组装方法之外,我们还发现了一种潜在的对冲策略,用于平衡 CRISPR 防御与天然能力的 A. baylyi 中的 DNA 获取。CRISPR(成簇的规律间隔的短回文重复序列)-Cas 系统是一种适应性免疫机制,通常通过检测和切割确定的靶序列 1 来保护细菌和古菌免受核酸入侵。CRISPR 系统包括 Cas(CRISPR 相关)蛋白,以及与同样短的 DNA 间隔区交替的同名短直接重复序列阵列。间隔序列被转录成较长的前体crRNA,然后前体crRNA被加工成单个crRNA(CRISPR RNA),每个crRNA由与特定核酸靶标互补的单个间隔序列以及通常源自重复序列的发夹柄组成。这些crRNA与Cas效应蛋白(如Cas9)或蛋白质复合物(如CASCADE)结合。一旦结合,它们就会根据系统引导效应子到互补的DNA或RNA上,效应子通常会切割这些DNA或RNA。很快,许多实验室就将CRISPR介导的DNA切割应用于从精确的基因组工程到基因回路2到靶向的细菌菌株去除3-6等各种应用。自扩散的CRISPR构建体也被用于快速产生纯合二倍体敲除(诱变链式反应)7,初步研究表明
一天内构建多重阵列以利用天然 CRISPR 系统
主要关键词