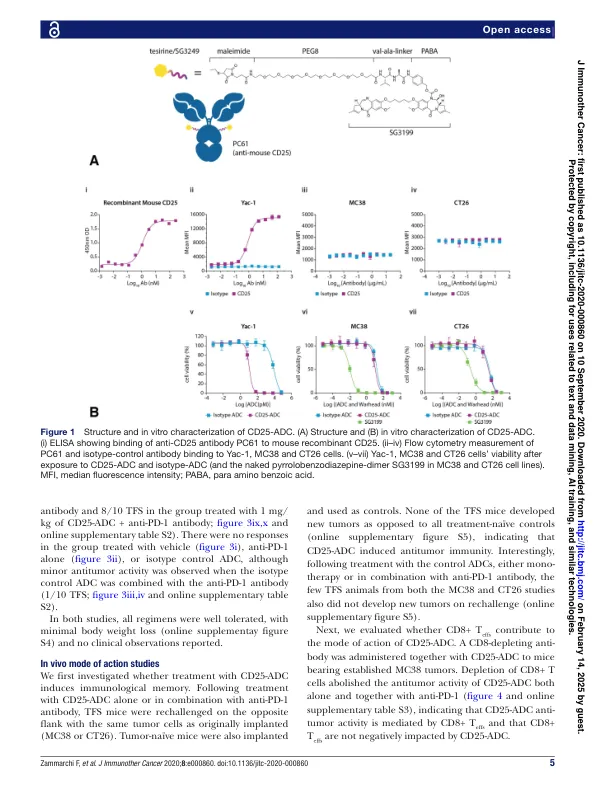
摘要 背景 调节性 T 细胞 (T regs) 有助于形成免疫抑制性肿瘤微环境。它们在具有高 T regs 浸润的肿瘤的建立和进展中发挥重要作用,并且是免疫疗法根除肿瘤的重大障碍。人们尝试了许多策略来消耗或阻断 T regs,尽管它们的成功率有限。方法 研究了一种靶向 CD25 的吡咯并苯二氮卓 (PBD) 二聚体的抗体-药物偶联物 (ADC) 消耗 T regs 和诱导抗肿瘤免疫的能力。在表现出表达 CD25 的 T regs 的肿瘤浸润的 CD25 阴性同基因模型中评估了 CD25-ADC 单独或与抗程序性细胞死亡蛋白 1 (PD-1) 抗体联合使用的抗肿瘤活性,并评估了其药效学和药代动力学。结果单次低剂量 CD25-ADC 在已建立的同基因实体瘤模型中产生强效而持久的抗肿瘤活性,并且次优剂量与 PD-1 阻断的组合具有协同作用。CD25 靶向 ADC 的肿瘤消除依赖于 CD8+ T 细胞,而 CD25-ADC 可诱导保护性免疫。重要的是,虽然 CD25-ADC 介导显著而持续的肿瘤内 T regs 耗竭,同时伴随着活化和增殖的肿瘤浸润 CD8+ T 效应细胞数量的增加,但全身性 T regs 耗竭是暂时的,从而减轻了对潜在自身免疫副作用的担忧。结论这项研究表明,基于 PBD 二聚体的 CD25 靶向 ADC 能够通过抗肿瘤免疫耗竭 T regs 并消除已建立的肿瘤。这代表了一种通过已知可诱导免疫原性细胞死亡的非常有效的 DNA 损伤毒素有效耗竭 T regs 的新方法。此外,这项研究为 ADC 作为免疫治疗剂的全新应用提供了概念证明,因为主要作用模式依赖于 ADC 直接靶向免疫细胞,而不是肿瘤细胞。这些强有力的临床前数据保证了对卡米丹鲁单抗特西林 (ADCT-301) 进行临床评估,卡米丹鲁单抗特西林是一种基于 PBD 的靶向人类 CD25 的 ADC,可以单独使用或与检查点抑制剂联合使用,用于已知 T regs 浸润的实体瘤。卡米丹鲁单抗特西林在部分晚期实体瘤患者中的 I 期试验 (NCT03621982) 正在进行中。
CD25 靶向抗体-药物偶联物消耗...
主要关键词