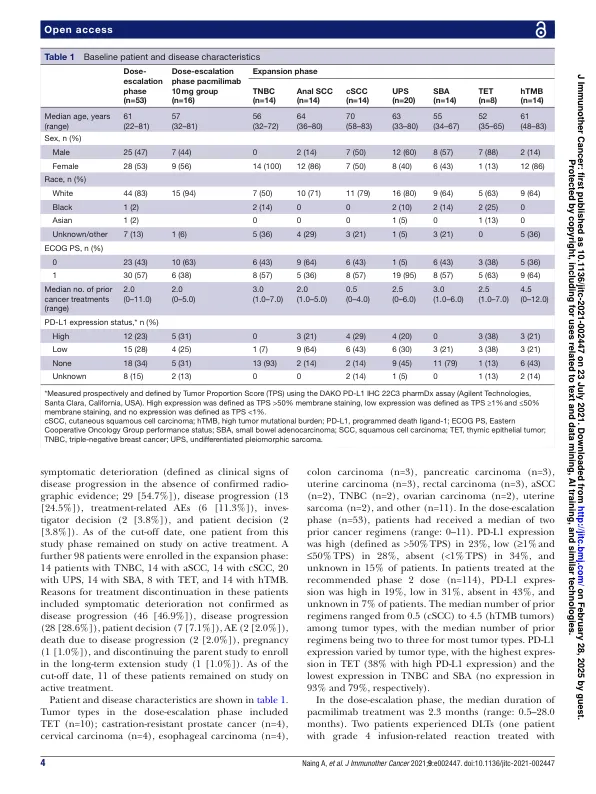
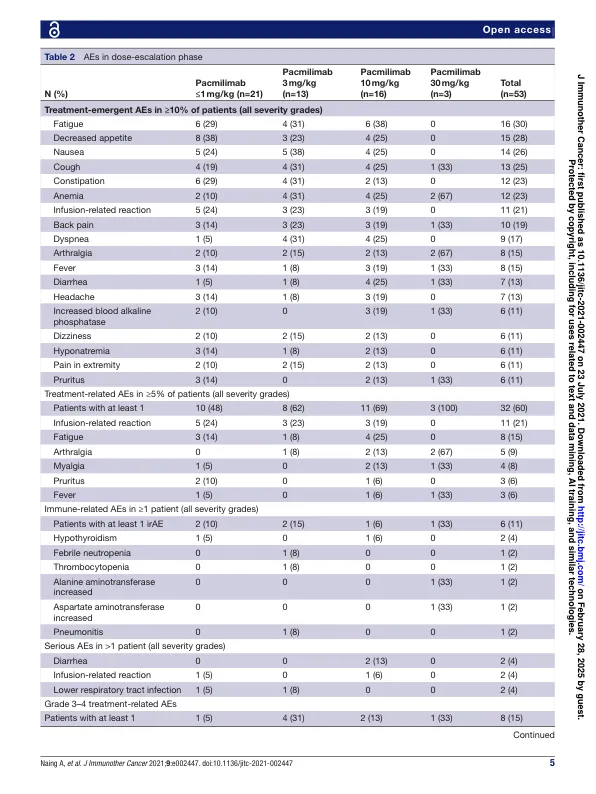
抽象的背景探针®治疗药是抗体前药,通过肿瘤相关蛋白酶在肿瘤微环境中激活,从而将活性限制为肿瘤微环境并最小化“非肿瘤”毒性。我们报告了CX-072(PACMilimab)的第一研究剂量 - 定量和单药扩展相位数据,这是针对针对编程死亡配体1(PD-L1)的概率检查点抑制剂。该多中心,开放标签研究(NCT03013491)的剂量升级阶段的方法,具有晚期实体瘤的成年人(天真到程序中降临至dephemed-Death-1/pd-l1或细胞毒性T-淋巴细胞毒性T-淋巴细胞4的抗原4抑制剂)与七剂量施用量施用七剂量的抑制作用。每14天静脉注射一次。主要终点是最大耐受剂量(MTD)的安全性和确定。在扩展阶段,患有六种预先指定恶性肿瘤之一(三阴性乳腺癌[TNBC];肛门鳞状细胞癌[ASCC];皮肤SCC [CSCC];未差异降低的多余型肉瘤[UPS];小肠腺癌[sba]和Thymic thymic [sba];或高肿瘤突变负担(HTMB)肿瘤。主要终点是客观响应(实体瘤的响应评估标准v.1.1)。结果,未达到30 mg/ kg的剂量达到MTD。根据扩展阶段的药代动力学和药效学发现,选择了10 mg/kg的建议2剂量(RP2D)。参加膨胀阶段的九十八名患者:TNBC(n = 14),ASCC(n = 14),CSCC(n = 14),UPS(n = 20),SBA(n = 14),TET(n = 8)和HTMB肿瘤(n = 14)。在RP2D接受PACMILIMAB的114例患者中,有10例患者(9%),6例患者(5%)的严重TRAES(5%)和由于两名患者的TRARES导致治疗停药(2%)(2%),据报道了与治疗相关的不良事件(TRAES)。≥3级与免疫相关的AE发生在两名患者中(皮疹,心肌炎)。高PD-L1表达(即> 50%的肿瘤比例评分)。在患者中观察到确认的客观反应
e001235.full.pdfCX-072(PACMILIMAB),Probody®PD
主要关键词