机构名称:
¥ 1.0
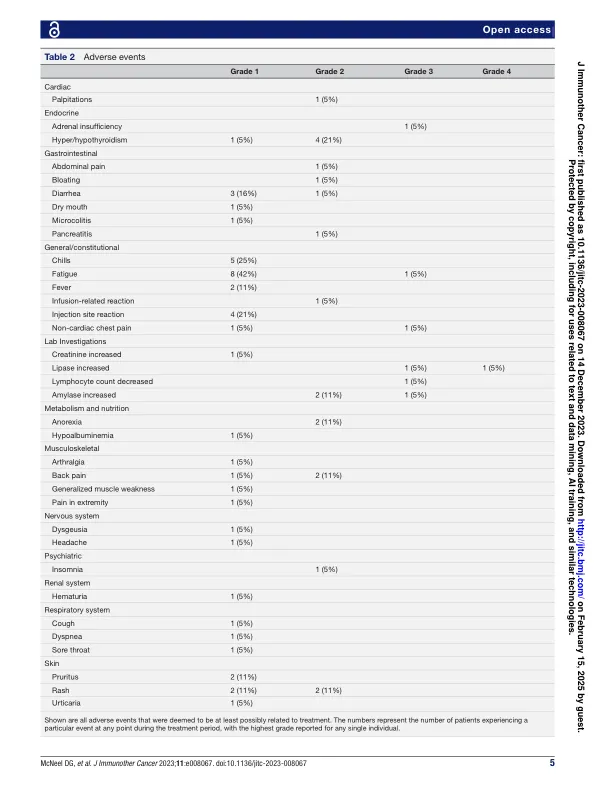
摘要 目的 我们之前曾报道,编码前列腺酸性磷酸酶的质粒 DNA 疫苗 (pTVG-HP) 与帕博利珠单抗联合用于转移性去势抵抗性前列腺癌患者时具有更高的临床活性。本试验旨在评估使用 nivolumab 进行 PD-1 阻断疫苗接种对早期复发性 (M0) 前列腺癌患者的影响。方法 M0 前列腺癌患者每 2 周接受 pTVG-HP (100 µg 皮内注射) 和 nivolumab (240 mg 静脉输注) 治疗,持续 3 个月,然后每 4 周治疗一次,共治疗 1 年。然后对患者进行额外一年的随访,停止治疗。主要目标是安全性和完全前列腺特异性抗原 (PSA) 反应 (PSA<0.2 ng/mL)。结果 共招募了 19 名患者。没有患者达到完全 PSA 反应的主要终点;然而,4/19 (21%) 患者的 PSA 下降 >50%。治疗前 PSA 倍增时间中位数为 5.9 个月,治疗中为 25.6 个月(p=0.001),停止治疗后一年为 9.0 个月。未达到总体中位放射学无进展生存期。3 级或 4 级事件包括肾上腺功能不全、疲劳、淋巴细胞减少和淀粉酶/脂肪酶升高。9/19 (47%) 患者出现免疫相关不良反应 (irAE)。irAE 的发展和 CXCL9 升高与 PSA 倍增时间增加有关。定量 NaF PET/CT 成像显示亚临床病变的消退以及每个时间点新病变的发展。结论 在这一人群中,联合使用 nivolumab 与 pTVG-HP 疫苗是安全的,并且具有免疫活性,延长了疾病进展的时间,但并不能根除疾病。定量成像表明,可能需要针对耐药机制的额外治疗来消除肿瘤。试验注册号 NCT03600350。
DNA 疫苗 (pTVG-HP) 和 nivolumab 的 2 期试验......
主要关键词