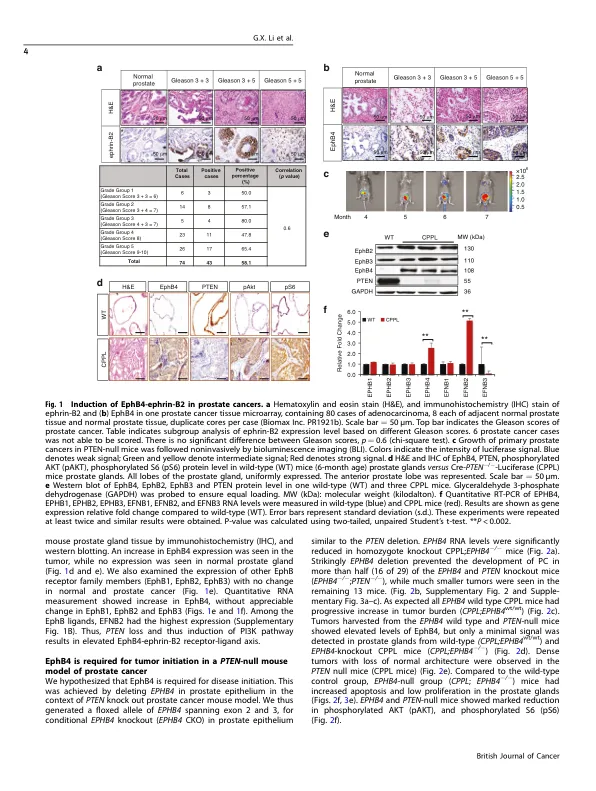
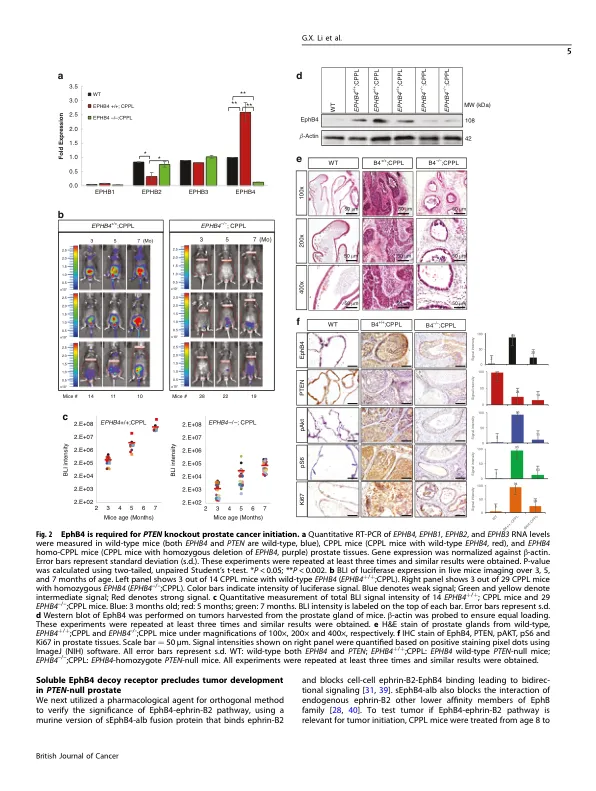
背景:PI3K途径激活是前列腺癌的常见和早期事件,来自PTEN中功能突变的丧失或在PIK3CA或AKT中激活突变,导致组成型激活,诱导生长因子受体受体激酶EPHB4及其配体Ephrin-B2。我们假设诱导EPHB4是肿瘤启动所需的早期事件。其次,我们假设当前列腺癌独立于雄激素时,EPHB4仍然相关。方法:前列腺上皮中有条件PTEN缺失的遗传小鼠模型诱导所有小鼠的肿瘤。我们针对EPHB4野生型测试了该模型,并在前列腺上皮中删除。这使我们能够测试其在肿瘤开始中的作用。我们还通过使用诱饵可溶性EPHB4来阻断由Ephb4-磷蛋白-B2相互作用引起的双向信号传导测试了正交方法。EPHB4-磷蛋白-B2在雄激素剥夺小鼠中的作用在难治性癌症模型中的作用进行了测试。结果:PTEN缺失在前列腺癌中诱导Ephb4和Ephrin-B2,当在同一前列腺上皮细胞中删除EPHB4时,它大大降低了。SEPHB4-ALB融合蛋白具有改进的药代动力学类似地抑制了肿瘤的形成,从而确立了在肿瘤启动中的作用。sephb4-alb保留了抗Cantatration抗抑制雄激素独立前列腺癌的效率。因此,我们已经观察到,在PTEN NULL小鼠中启动前列腺癌需要诱导EPHB4,并且在雄激素剥夺中需要从EPHB4下游的信号传导,从而需要抑制前列腺癌。EPHB4途径的药理抑制作用再现了结果。 靶向EPHB4应在前列腺癌中进行测试,尤其是那些对雄激素剥夺疗法有抵抗力的人。 结论:ephb4和ephrin-b2受体配体对PTEN null前列腺癌被诱导,这显着促进了肿瘤起始。 其次,即使在雄激素剥夺中,EPHB4-磷蛋白-B2途径也会继续促进肿瘤进展,从而激素难治性肿瘤。 EPHB4-磷蛋白-B2可能是精密药物的候选者,具有基于生物标志物的患者选择,没有和不同时护理标准。EPHB4途径的药理抑制作用再现了结果。靶向EPHB4应在前列腺癌中进行测试,尤其是那些对雄激素剥夺疗法有抵抗力的人。结论:ephb4和ephrin-b2受体配体对PTEN null前列腺癌被诱导,这显着促进了肿瘤起始。其次,即使在雄激素剥夺中,EPHB4-磷蛋白-B2途径也会继续促进肿瘤进展,从而激素难治性肿瘤。EPHB4-磷蛋白-B2可能是精密药物的候选者,具有基于生物标志物的患者选择,没有和不同时护理标准。
ephb4-磷蛋白-B2是抑制前列腺癌的靶标
主要关键词