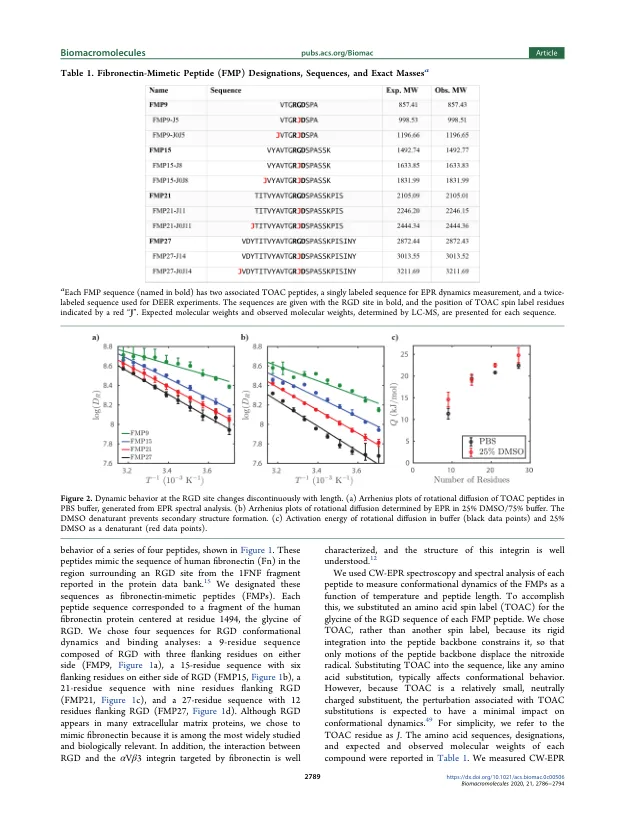
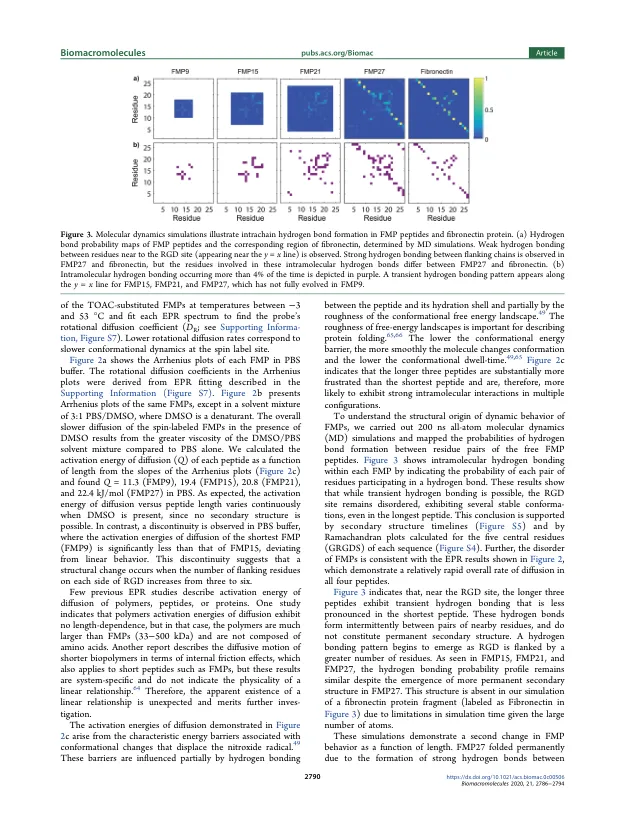
机构名称:
¥ 1.0
摘要:RGD 是用于生物材料中促进细胞粘附的大量三肽的例子,但游离或表面结合的 RGD 三肽的效力比天然蛋白质中的 RGD 结构域低几个数量级。我们设计了一组长度不等的肽,由中心三个残基为 RGD 的纤连蛋白片段组成,以便在不改变结合位点化学环境的情况下改变它们的构象行为。利用这些肽,我们测量了活性位点的构象动力学和瞬态结构。我们的研究揭示了侧翼残基如何影响构象行为和整合素结合。我们发现结合位点的无序对 RGD 肽的效力很重要,并且 RGD 位点附近的瞬态氢键会影响肽的能量景观粗糙度和肽结合。这种现象与长程折叠相互作用无关,有助于解释为什么短结合序列(包括 RGD 本身)不能完全复制细胞外基质蛋白的整合素靶向特性。我们的研究强调肽结合是一个整体事件,在设计功能性生物材料的肽表位时,应考虑比直接参与结合的片段更大的片段。■ 简介
含 RGD 延伸肽的构象动力学