机构名称:
¥ 2.0
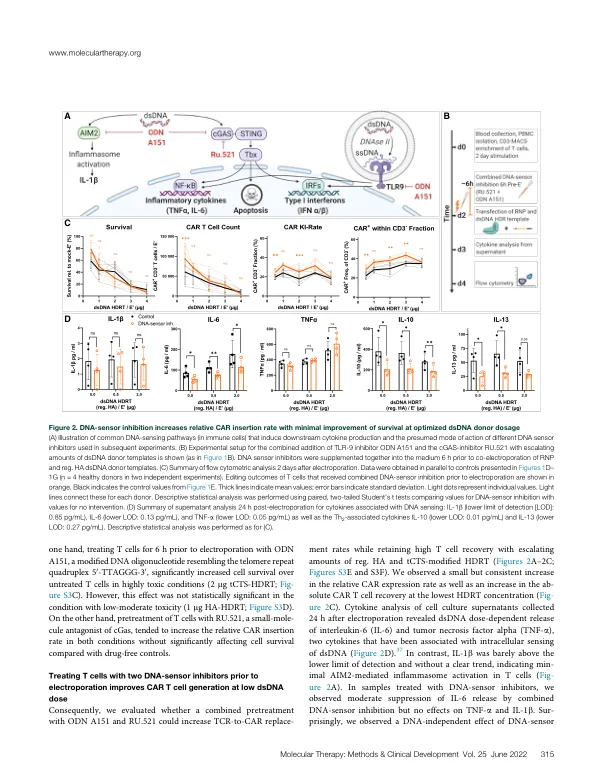
嵌合抗原受体 (CAR) 重定向 T 细胞是治疗血液系统恶性肿瘤的有效选择。目前,CAR T 细胞的主要制造方法依赖于逆转录病毒转导。随着基因编辑的出现,使用腺相关病毒进行基因转移将 CD19-CAR 插入 T 细胞受体 (TCR) α恒定区 (TRAC) 基因座已得到证实,并且这些 CD19-CAR T 细胞比逆转录病毒转导的细胞表现出更好的功能性。然而,临床级病毒生产很复杂,而且成本高昂。在这里,我们优化了一种无病毒基因组编辑方法,使用 CRISPR-Cas 和双链模板 DNA (dsDNA) 通过核酸酶辅助同源性定向修复 (HDR) 将 CAR 有效地插入原代人类 T 细胞的 TRAC 基因座。我们评估了 DNA 传感器抑制和 HDR 增强作为两种药物干预措施,分别以提高细胞活力和相对 CAR 敲入率。虽然转染的 dsDNA 的毒性无法完全预防,但两种干预措施的结合显著提高了 CAR 敲入率和 CAR T 细胞产量。由此产生的 TRAC 替代 CD19-CAR T 细胞在体外表现出抗原特异性细胞毒性和细胞因子产生,并在异种移植小鼠模型中减缓了白血病进展。扩增子
单元 - MDC 存储库