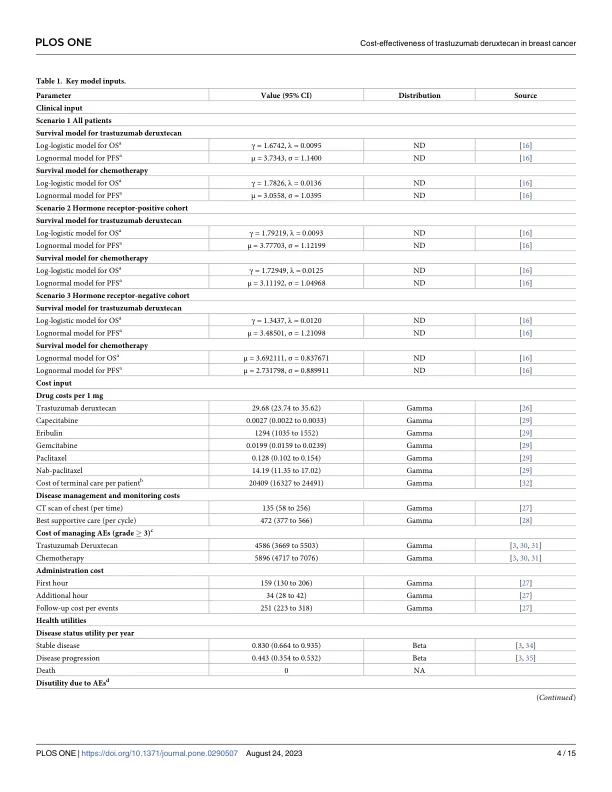
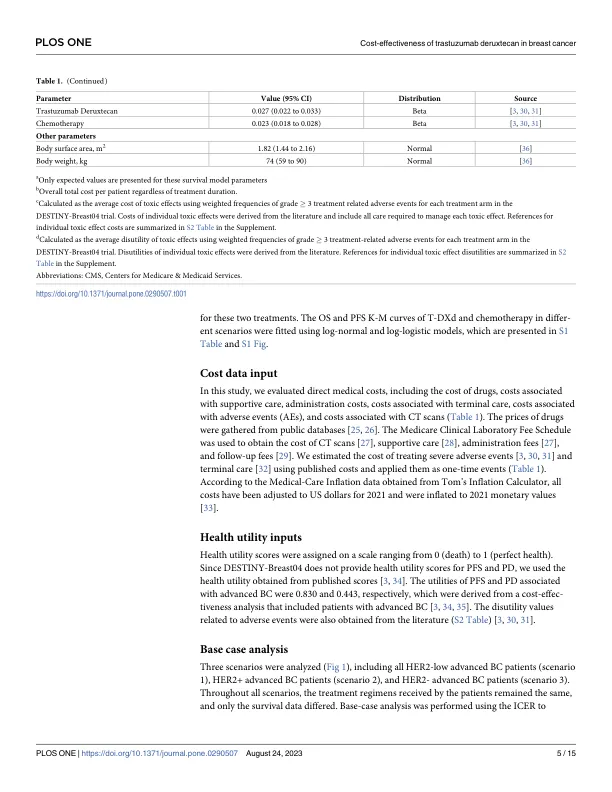
乳腺癌 (BC) 是女性中最常见的癌症 [1]。早期发现、手术、放射治疗和全身治疗已将 I-III 期 BC 患者的总生存率 (OS) 提高至 70%–80% [2],然而,约 30% 的早期 BC 女性会发展为晚期或转移性癌症 [3]。乳腺癌预后不良加上高发病率,使其成为全球女性癌症相关死亡的第二大原因,仅次于肺癌,主要是因为大多数晚期疾病患者的预后不良 [1,4]。除患者和疾病特征外,BC 的分子亚型在预后和治疗决策中也发挥着重要作用。大约 20% 的 BC 病例与人表皮生长因子受体 2 (HER2) 过度表达有关 [5]。在过去的二十年中,晚期乳腺癌的全身治疗格局发生了显著变化,主要进展发生在激素受体阳性 (HR+)/HER2 阴性 (HER2-) 和 HER2 阳性 (HER2+) 病例的治疗方面 [ 4 ]。几种类型的 HER2 靶向疗法已用于治疗转移性乳腺癌,包括曲妥珠单抗-美坦新、曲妥珠单抗、帕妥珠单抗和拉帕替尼 [ 6 ]。约 60% 的 HER2- 转移性表达的 BC 病例表现出低水平 HER2,定义为免疫组织化学 (IHC) 评分为 1+ 或 2+ IHC 评分,且原位杂交结果 (ISH) 为阴性 [ 7,8]。 “HER2-low”一词用于描述 HR+ 和激素受体阴性 (HR-) BC,这些患者对全身化疗的反应取决于其预后 [ 7 , 8 ]。此类亚型患者尚未从现有的 HER2 靶向疗法中获益 [ 9 , 10 ];因此,HER2-low 状态的 BC 目前被视为 HER2-(HER2-low 和 HER2-zero)治疗,患者根据激素受体状态分层 [ 4 , 8 , 11 ]。一般而言,主要治疗后病情进展的患者接受靶向治疗的选择有限,最常见的是接受包含单一药物的姑息化疗 [ 4 , 8 , 11 ]。曲妥珠单抗 deruxtecan(以前称为 DS-8201,T-DXd)已获批用于治疗转移性 HER2+ BC 患者,该药物采用可裂解连接体,其中含有与拓扑异构酶 I 抑制剂连接的人源化抗 HER2 单克隆抗体 [12, 13]。通过旁观者效应,T-DXd 除了靶向 HER2 水平高的表达 HER2 的肿瘤细胞外,还可以将其细胞毒性有效载荷递送到异质表达 HER2 的邻近肿瘤细胞 [13, 14]。先前发表的 RCT 已证明该药物对接受过治疗的转移性 HER2 低晚期 BC 患者有良好的疗效 [15, 16]。根据最近发表的 3 期 RCT DESTINY-Breast04 报告,52.3% 的 HER2 低表达晚期 BC 患者总体缓解,无进展生存期为 9.0 至 11.3 个月 [ 16 ]。结果
曲妥珠单抗德鲁替康治疗 HER2 低晚期乳腺癌的成本效益
主要关键词