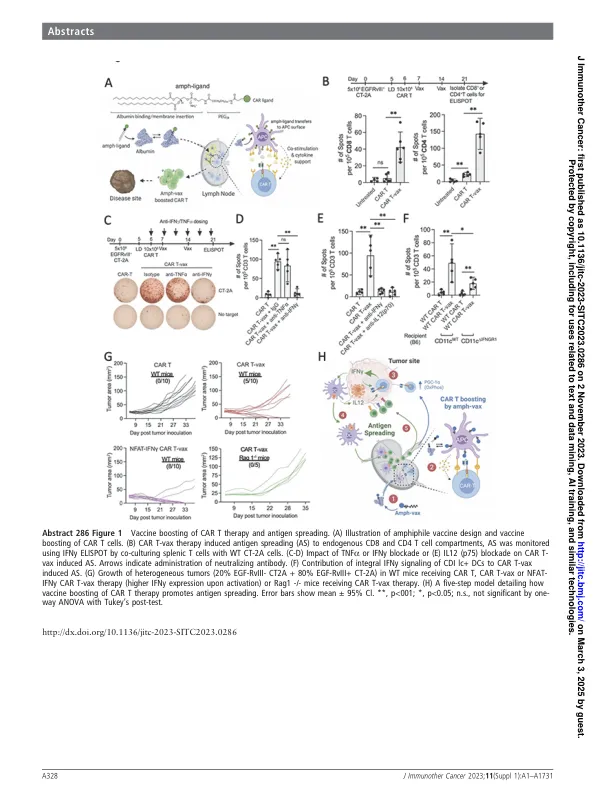
背景嵌合抗原受体(CAR)T细胞疗法在实体瘤中令人失望。一个关键的障碍是先前存在的抗原异质性,并非所有肿瘤细胞表达汽车靶向的抗原。抗原分布(AS)是对与原始疗法靶标不同的二级抗原的免疫反应的诱导和扩增。可以在抗肿瘤周围T细胞库的扩张和扩展中发挥重要作用。我们最近开发了一种合成疫苗(AMPH-VAX),以通过直接调节CAR T细胞来增强对实体瘤的CAR T细胞活性,并通过AS 1 2通过AS 1 2(图1A)吸收宿主免疫。方法通过将car含量(即本提案中的pepviii)连接到白蛋白结合聚(乙二醇)磷脂来产生AMPH-VAX,然后用环状-DI-GMP(Sting Agonist)配制。我们使用了表达肿瘤特异性表面抗原EGFRVIII的CT-2A鼠胶质母细胞瘤模型。结果在CD4+和CD8+ T-Cell室中都引起了明显的抗原分散(AS),但不单独使用CAR T疗法Amph-Vax增强了CAR T(CAR T-VAX)治疗(图1B)。21,835个肿瘤内源性T细胞的单细胞RNA-SEQ证实了细胞毒性CD8 T细胞的显着增加和TH1 CD4 T细胞的诱导。跨性别分析表明,疫苗促进疫苗的增强显着增强了CAR T细胞代谢,包括氧化磷酸化(OXPHOS)。使用PGC-1 A-缺陷型CAR T-VAX治疗减少了〜50%。IFN G封锁被废除为(图1C,d)。IFN G封锁被废除为(图1C,d)。使用抗IL12(p75)抗体或IL12RB2基因敲除小鼠的IL12信号传导的封锁态ifn g封底,导致可忽略不计为(图1E)。我们进一步观察到在CD11C+ DC中IFN G信号不足的BATF3二氧化体小鼠或小鼠中的AS显着降低(图1F)。最后,我们表明IFNGR1-或IL12RB2缺陷型CAR T-VAX治疗未能诱导AS。使用EGFRVIII+和EGFRVIII-CT-2A细胞以预定比率混合的异质性肿瘤模型,我们发现CAR-T VAX治疗的〜50%动物携带的肿瘤含有高达20%EGFRVIII的肿瘤,并进一步升高了CAR T-IFN G表达的升高率增加了Cure Cure速率(增加了80%),并增加了80%(图)。和具有内源性T细胞且因此没有抗原扩散的RAG1 - / - 小鼠中的治疗反应完全损失(图1G)。结论是通过与DC衍生的IL-
286疫苗增强的汽车T串扰宿主免疫...
主要关键词