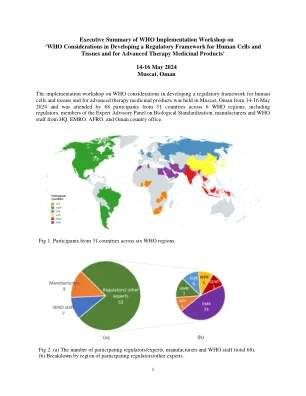
在为期三天的研讨会中,在最近发表的文档中概述了“在为人类细胞和组织开发监管框架以及晚期治疗药物产品的考虑方面的考虑因素”,并在七个公开会议中进行了讨论。研讨会的议程已包含在本文档的末尾。细胞,组织和基因治疗产物(CGTP)代表了对复杂性的生物产物,来自那些需要最小的监督(例如简单的同种异体皮肤移植物)(例如嵌合抗原受体T细胞)的生物学产品,这些抗原受体T细胞需要大量的调节性评估以证明产品安全性和效率在营销授权之前。在研讨会上讨论了生物产品的光谱和关键风险考虑因素。讨论了一种基于风险的CGTP,分类,CGTP的术语以及全球协调的重要性,尤其是在术语上的重要性。会议包括讨论CGTP的监管方法,分类和术语的考虑,以及国家监管局(NRA)代表对国家监管景观的观点。制造商对当前CGTP开发状态的看法也在会议上进行了讨论,以及谁在支持国家加强其监管系统并建立技术能力以调节CGTP的国家中的作用。讲习班总结了建议的下一步。表1。基于风险的监管方法的CGTP案例研究小组活动包括对三个案例研究的讨论:1)最低生产的组织,用于接受者与供体相同功能:受辐射的,无菌的人类皮肤皮肤,2)需要全面的预上市授权的生物产品,并证明安全性和有效性:自体CAR T细胞产品靶向CD19和3)在受益方面和3)与受体相同的plotic and Is functore n和Donor的pant portor:Allog:Allog and donor:Allog:Allog:Allog:Allog nog poror:Allog and prore portor:Allog and prore portor:Allog and donor portor:间充质干细胞(MSC)。总体而言,对基于案例的研究的审查重申了对基于风险的细胞和基因治疗产品分类方法的紧迫需求,并且需要提高制造依从性(GTP vs GMP)使用较高风险产品的需求。参与者强调,迫切需要对最小操纵和同源用途进行协调的定义,以防止误解,因为对监管框架的不同解释(或缺乏监管框架)的不同解释可能会使“不良玩家”对“不良玩家”的吸引力,以使其对细胞和基因治疗市场更具吸引力,并且可能对患者产生损害。还提出了至关重要的一点,即需要与教育和提供足够的信息同时完成此类监管框架。
执行谁实施研讨会
主要关键词