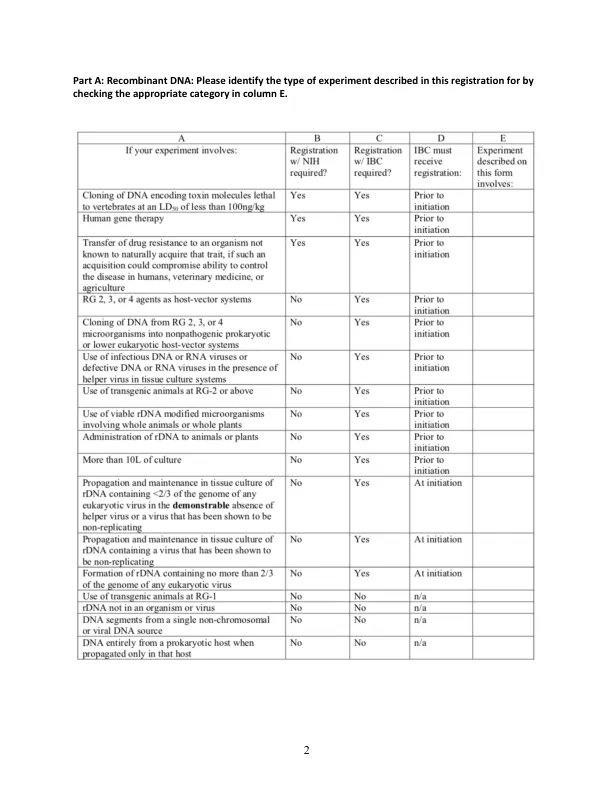
首席研究员:_______________________________ 部门:__________________________________ 电话: 电子邮件:__________________________________ 办公室地点:__________________________________ 实验室地点:__________________________________ 项目名称:__________________________________ 提交日期:_________________________________ 请将填妥的表格寄回给 HIBC 官员兼汉密尔顿机构生物安全委员会主席 Siobhan Robinson,地址:3065 Science Center,或发送电子邮件至 sxrobins@hamilton.edu 一般说明:此表格旨在确保遵守 NIH/CDC 关于研究实验室生物安全的指南和 ASM 关于教学实验室生物安全的指南。此表格确保您; 了解研究中涉及的潜在危害,设计实验以尽量减少此类危害,并已将这些潜在危害和保护措施传达给参与研究或实验室维护的任何人。在某些情况下,将多个生物/实验合并到一份表格中可能是合适的。如果表格清晰易懂,那么 PI 可以随意将多个实验/生物添加到此表格中。请标记您将要完成的部分 A 部分:重组 DNA 实验。指出 DNA 的任何不良影响、所用培养物的数量以及实验描述。还请提供有关 rDNA 系统中使用的 DNA 插入物、载体和宿主细胞的详细信息。有关更多信息,请访问 NIH 网站:https://osp.od.nih.gov/wp-content/uploads/NIH_Guidelines.pdf B 部分:致病微生物。能够在免疫正常的健康成人中引起疾病的病原体必须在 B 部分中注册。这些病原体包括 CDC《微生物和生物医学实验室生物安全》最新版出版物中归类为 RG-2 或更高级别的生物。 https://www.cdc.gov/labs/BMBL.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fbiosafety%2 Fpublications%2Fbmbl5%2Findex.htm RG-2 或更高级别需要注册。C 部分:人类血液、细胞系、组织或其他潜在传染性材料 (OPIM)。这些物品,包括从商业来源获得的已建立的人类/灵长类动物细胞系,也包括在此要求中。OPIM 是可能传播 HIV、HBV、HCV 和其他血液传播疾病的材料,包括已知感染任何这些病原体的动物组织、微生物储库和培养物、某些体液、未固定的人体组织、原代组织/细胞培养物,必须在 C 部分注册。这些必须在 RG-2 条件下处理,就像它们是原代细胞或组织一样。欲了解更多信息,请访问 CDC 网站:http://www.cdc.gov/biosafety/publications/bmbl5/index.htm D 部分:对上述任何选择的动物进行管理。向动物施用上述任何药剂均需获得 IACUC 的批准,并且可能还要求将动物饲养在专用笼子中并在 RG-2 条件下处理。第 E 部分:安全措施。所有注册都必须填写此部分。第 F 部分:确认。所有注册都必须填写此部分。
汉密尔顿机构生物安全委员会 (HIBC) 协议...
主要关键词