机构名称:
¥ 1.0
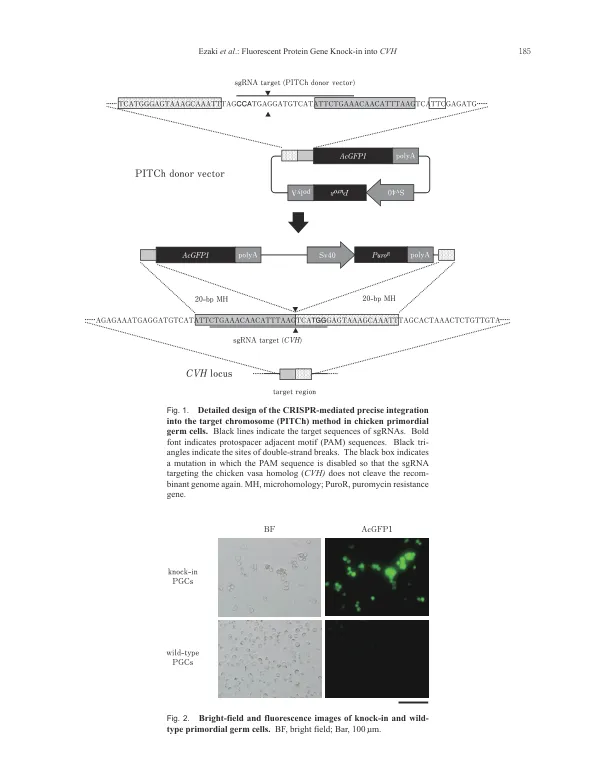
在鸡中,原始生殖细胞 (PGC) 是基因敲入等高级基因组编辑的有效靶点。尽管已经建立了鸡 PGC 的长期培养系统,但仍有必要选择一种高效、精确的基因编辑工具来编辑 PGC 基因组,同时保持其对生殖系统的贡献能力。与传统用于生成敲入鸡的同源重组方法相比,成簇的规律间隔短回文重复序列 (CRISPR)/CRISPR 相关蛋白 9 (Cas9) 和 CRISPR 介导的精确整合到目标染色体 (CRIS-PITCh) 方法更胜一筹,因为供体载体更易于构建、基因组编辑效率高,并且不会选择目标细胞。在本研究中,我们利用 CRIS-PITCh 方法将荧光蛋白基因盒作为融合蛋白整合到鸡 PGC 的鸡血管同源物 ( CVH ) 基因座中,从而设计了敲入鸡 PGC。敲入 PGC 在体内和体外均表达荧光蛋白,便于对 PGC 进行追踪。此外,我们还表征了设计双敲入细胞系的效率。通过有限稀释获得敲入细胞克隆,并通过基因分型确认设计双敲入细胞系的效率。我们发现 82% 的分析克隆都成功敲入了两个等位基因。我们认为,从敲入 PGC 中生产模型鸡可用于各种研究,例如阐明鸡的生殖细胞命运和性别决定。
将荧光蛋白基因定向敲入鸡体内