机构名称:
¥ 3.0
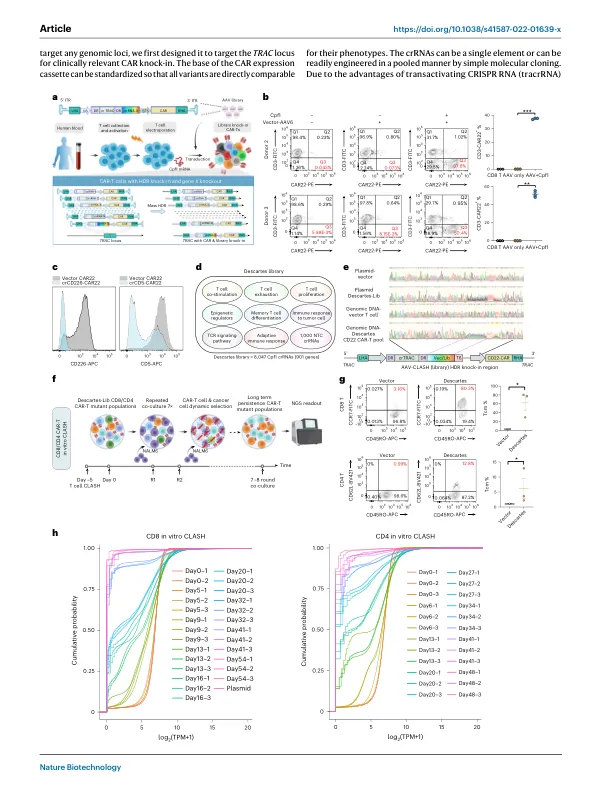
靶向基因敲入在细胞治疗中的应用效率普遍较低,规模有限。本研究开发了CLASH系统,该系统能够实现高效、高通量的基因敲入工程。在CLASH中,Cas12a/Cpf1 mRNA与混合腺相关病毒结合,通过大规模并行同源定向修复介导同时基因编辑和精准转基因敲入,从而产生一个稳定整合的突变变体池,每个变体都具有靶向基因编辑功能。我们将该技术应用于原代人T细胞,并使用CD3、CD8和CD4 T细胞在血癌和实体瘤模型中进行了时间进程式CLASH实验,从而实现了有利的CAR-T变体的混合生成和无偏选择。 CLASH 实验中出现了一种独特的 CRISPR RNA (crRNA),它可以在 CAR-T 中生成 PRDM1 的外显子 3 跳跃突变,从而增强这些细胞的增殖、干细胞样特性、中枢记忆和寿命,从而在多种癌症模型(包括实体瘤模型)中提高体内疗效。CLASH 的多功能性使其广泛应用于各种细胞和治疗工程应用。
人类 T 细胞的大规模并行敲入工程