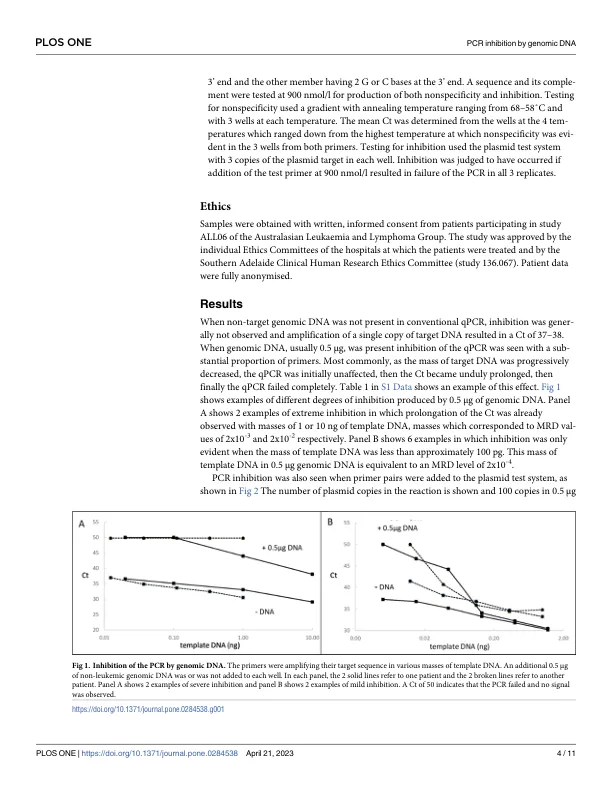
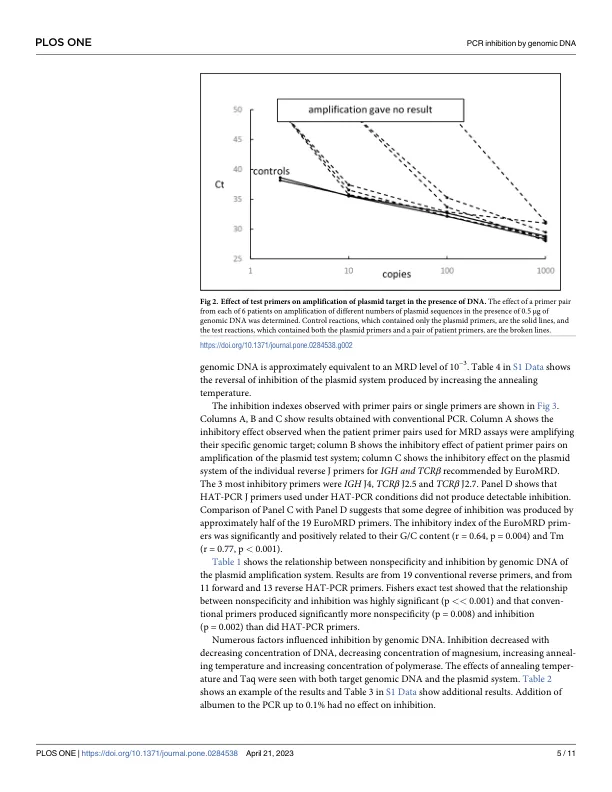
通常通过 PCR 对淋巴肿瘤中的微小残留病 (MRD) 进行灵敏的定量分析,使用免疫球蛋白或 T 细胞受体基因重排作为靶标,并使用患者或等位基因特异性寡核苷酸 (ASO) 作为引物。自 30 年前首次描述以来,ASO-qPCR 得到了广泛的应用,尤其是在欧洲,欧洲MRD 联盟成员发表的论文提供了有关该方法执行的指南和通用反向引物的推荐序列 [1-3]。如果候选患者特异性正向引物可以将 MRD 定量到 10 −4 的水平,则可以使用它,该引物的序列是患者独有的并且是特定于患者的。一些引物可以定量到 10 −4 以下,但有些会失败 [4]。失败有时可能是由于假阳性,但原因通常不清楚。 HAT-PCR(高 A/T PCR 或高退火温度 PCR)是 qPCR 的一种最新改进,其涉及引物设计和扩增条件的改进,以提高特异性并降低 MRD 检测中假阳性结果的频率 [5]。当检测 20 μg DNA 时,它的检测限为 10 −65 。在开发 HAT-PCR 之后,研究了根据欧洲 MRD 指南使用患者特异性正向引物和推荐的反向 J 引物进行的传统 qPCR 的灵敏度。单个引物对通常可以检测到低至 10 −4 的 MRD 水平,但经常无法检测到更低的水平。PCR 可以潜在地将单个靶标扩增到检测点 [6],但靶标的扩增有时会被与基因组 DNA 同时纯化的外在物质或另一种内在扩增反应所抑制。引物二聚体扩增引起的抑制很常见,人们已对 PCR 进行了多项技术改进以尽量减少这种抑制 [ 7 , 8 ]。其他脱靶 DNA 序列的扩增反应也已被观察到 [ 9 ],但此类反应的特征不甚了解,其重要性尚不清楚。传统 qPCR 无法将 MRD 定量低于 10 −4,这被证明是由于引物与基因组 DNA 相互作用造成的。除了有报道称碎片化的基因组 DNA [ 10 ] 可能会抑制 PCR 外,基因组 DNA 在 PCR 中的作用并未引起人们的兴趣。但是,我们认为分析这种现象很重要,原因有二。首先,了解和预防它可以提高 MRD 定量的灵敏度。其次,其他 PCR 检测需要在存在基因组 DNA 的情况下灵敏地检测靶标,因此可能容易受到抑制。因此,分析抑制及其预防机制可能与许多 PCR 检测的设计相关。
基因组 DNA 对 PCR 的抑制
主要关键词