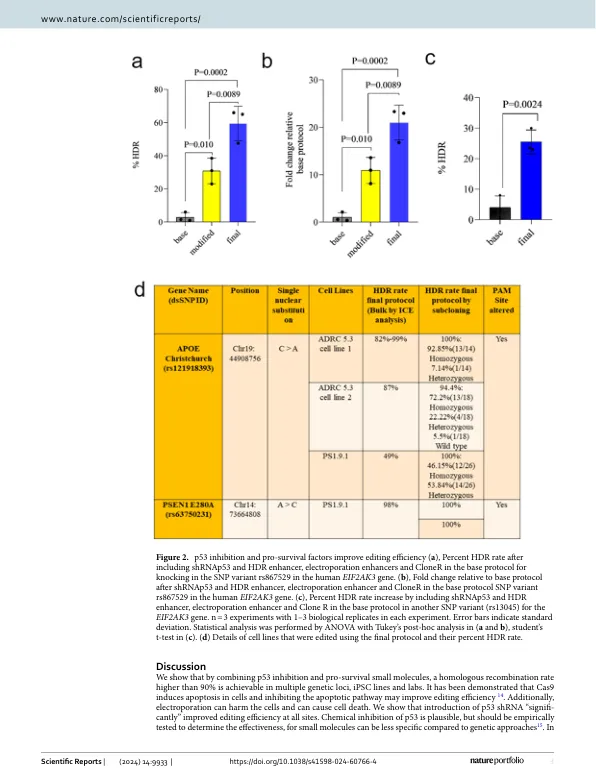
基因组编辑是生物技术领域中开发的最强大的工具之一。改变生物体的基因组的能力使科学家能够在更复杂的系统中研究挑战性的进化和药用问题1。全基因组关联研究(GWAS)产生了大量的单核苷酸多态性(SNP),与疾病风险增加相关的遗传变异2。基因编辑允许生产含有SNP的基因工程的同源线,这些细胞可能说明了这种遗传突变如何引起疾病。编辑水平从理论上简单的基因敲除到更复杂的编辑,例如完整的基因插入或点突变。尽管基因组编辑技术已经快速提高,但仍未解决的几个挑战3 - 5。群集定期间隔短的短质体重复序列(CRISPR)已成为动植物模型中基因组编辑的首选方法6。当前方法通常使用核酸酶变体Cas9和cas12a 6。CRISPR -CAS9和-CAS12A系统与指南RNA(GRNA)相互作用,该导向RNA(GRNA)由两个段组成:CRISPR RNA(CRRNA)指定基因组靶点位点和反式激活CRISPR RNA(TRACRRNA),这些crispr rna(tracrRNA)直接与CAS与CAS核蛋白结合以形成核糖核蛋白蛋白(RNP)7。与先前的基因改变技术相比,创新的CRISPR-CAS基因编辑技术更简单,更负担得起配置,从而导致了广泛的利用率2、8、9。我们假设我们可以通过抑制p53激活,从而提高编辑效率来改善细胞恢复。然而,尽管CRISPR-CAS编辑系统取得了重大进展,但迫切需要进一步的优化以提高效率和成功编辑的百分比,尤其是当多种风险变体与感兴趣的基因相关联时,就需要通过敲击多个遗传修饰的多种SNP产生具有不同SNP的多线。在这项研究中,我们旨在开发一种高效且易于适应的基因编辑方案,以克服目前限制细胞系中点突变效率的障碍。由于与CRISPR和单细胞克隆10相关的双链染色体断裂而引起的明显细胞死亡。另一方面,据报道,抑制相关激酶(岩石)或p53途径可通过预防细胞死亡8来提高编辑效率8。
IPSC中使用CRISPR的高效精确基因组编辑方法
主要关键词