机构名称:
¥ 1.0
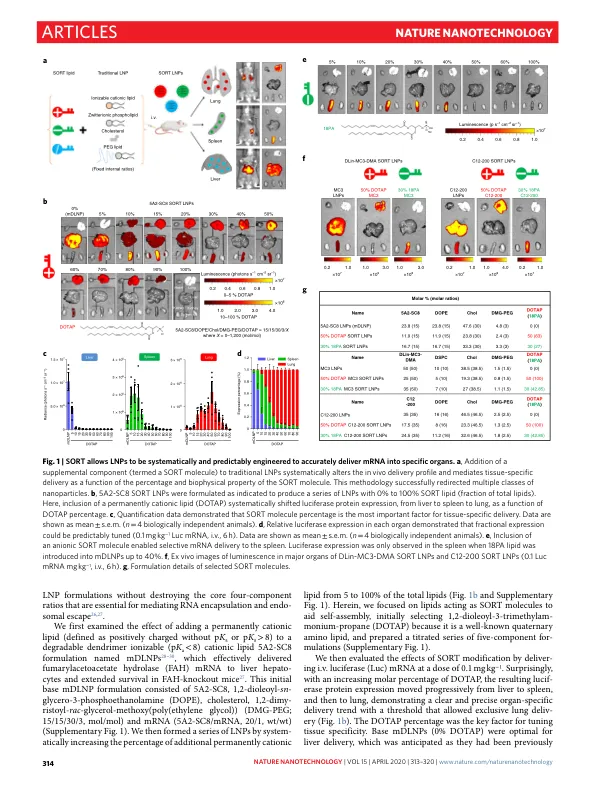
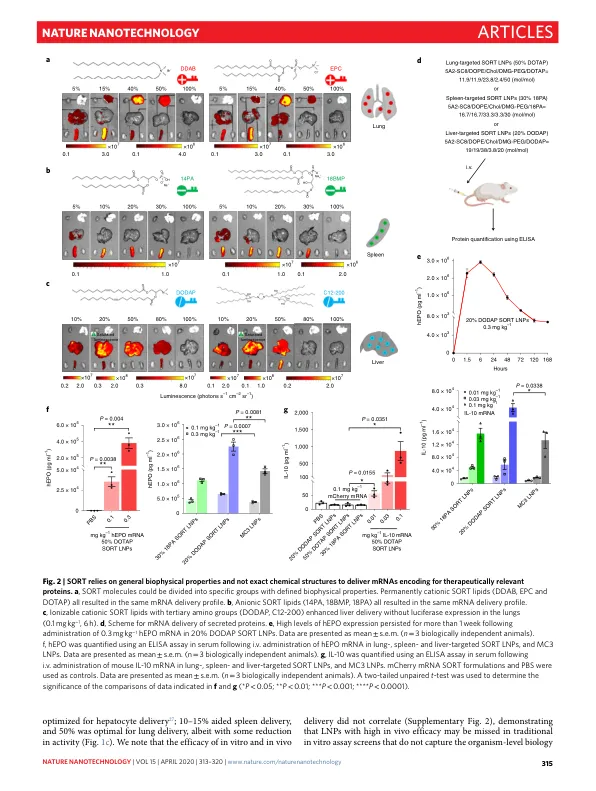
基于 CRISPR–Cas 的基因编辑 1 – 3 和基于信使 RNA 的基因替换技术 4,5 的发展开创了一个充满希望的时代,有望为目前无法治疗的遗传病 6 – 8 带来新的治疗方法。由于突变蛋白是在特定细胞中产生的,因此迫切需要开发器官特异性的递送策略,以充分发挥基因组药物的潜力。非病毒合成纳米颗粒是一种安全有效的方法,可以重复给药。在可用的载体中,脂质纳米颗粒 (LNP) 代表了一类可以将治疗性核酸递送到肝脏的材料 2,4,9,包括最近美国食品和药物管理局批准的一种用于治疗转甲状腺素蛋白介导的淀粉样变性的短干扰 RNA LNP 疗法,称为 Onpattro 10。尽管取得了这些进展,但目前还无法可预测和合理地设计纳米颗粒以递送到肝脏以外的目标组织。我们报告了一种称为选择性器官靶向 (SORT) 的策略,该策略可以系统地设计纳米粒子,以便在静脉 (iv) 给药后将各种货物(包括 mRNA、Cas9 mRNA/单向导 RNA (sgRNA) 和 Cas9 核糖核蛋白 (RNP) 复合物)准确递送到小鼠的肺、脾和肝脏(图 1a)。传统的 LNP 由可离子化的阳离子脂质、两亲性磷脂、胆固醇和聚乙二醇 (PEG) 脂质组成。在这里,我们表明添加补充成分(称为 SORT 分子)可精确改变体内 RNA 递送特性,并介导组织特异性基因递送和编辑,这取决于 SORT 分子的百分比和生物物理特性。在这项工作中,我们为组织特异性递送提供了证据,确定该方法适用于各种纳米颗粒系统,并提供了一种可预测的 LNP 设计新方法,以靶向治疗相关细胞。传统上,有效的细胞内递送材料依赖于可电离胺的最佳平衡来结合和释放 RNA(p K a 介于 6.0 和 6.5 之间)和纳米颗粒稳定剂
用于组织学的选择性器官靶向 (SORT) 纳米粒子......
主要关键词