机构名称:
¥ 1.0
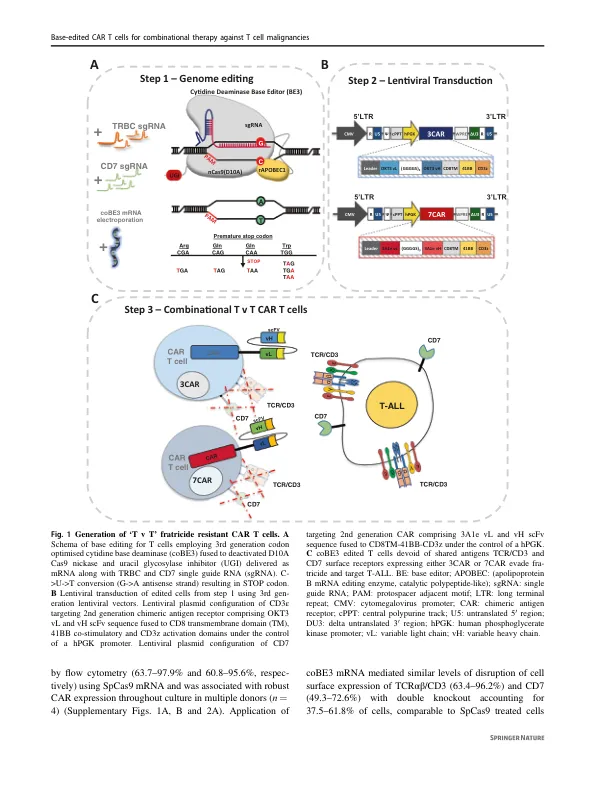
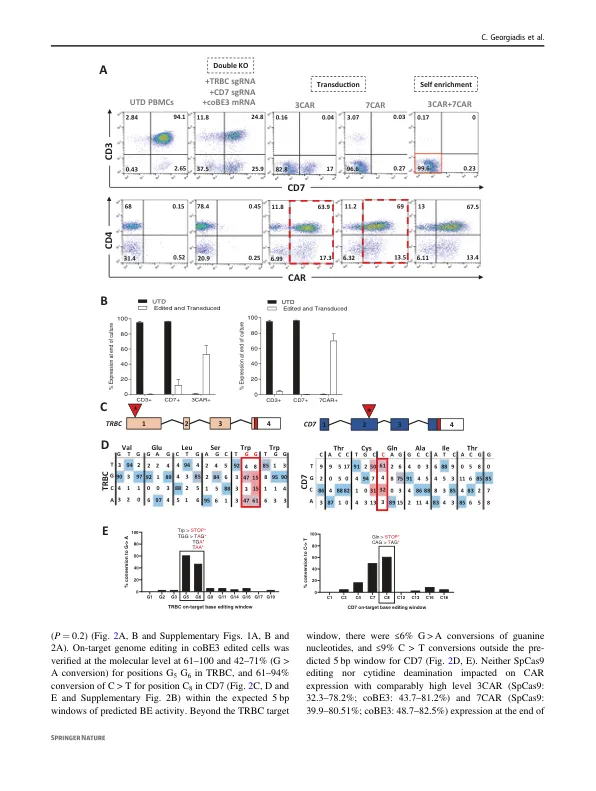
摘要 使用嵌合抗原受体 (CAR) T 细胞靶向 T 细胞恶性肿瘤受到针对 CD3 和 CD7 等共享抗原的“ T v T ”自相残杀的阻碍。碱基编辑通过创建终止密码子或消除剪接位点,提供了无缝中断有问题抗原的基因表达的可能性。我们描述了通过在慢病毒介导的 CD3 或 CD7 特异性 CAR 表达之前有序去除 TCR/CD3 和 CD7 来产生抗自相残杀的 T 细胞。对碱基编辑细胞的分子询问证实了在常规 Cas9 处理的细胞中检测到的染色体易位的消除。有趣的是,3CAR/7CAR 共培养导致“自我富集”,产生了 99.6% TCR − /CD3 − /CD7 − 的群体。 3CAR 或 7CAR 细胞能够对具有明确 CD3 和/或 CD7 表达的白血病细胞系以及原代 T-ALL 细胞发挥特异性细胞毒性。共培养的 3CAR/7CAR 细胞在体外和体内人:鼠嵌合模型中对 CD3 + CD7 + T-ALL 靶标表现出最高的细胞毒性。据报道,APOBEC 编辑器可以表现出 DNA 和 RNA 的向导独立的脱氨作用,但我们没有发现影响 CAR 抗原特异性结合区域的有问题的“脱靶”活性或混杂碱基转换,否则可能会重定向 T 细胞特异性。联合输注抗自相残杀的抗 T CAR T 细胞可能在 T 细胞恶性肿瘤的异基因造血干细胞移植之前增强分子缓解。
碱基编辑的 CAR-T 细胞用于治疗 T 细胞恶性肿瘤的联合治疗
主要关键词