机构名称:
¥ 1.0
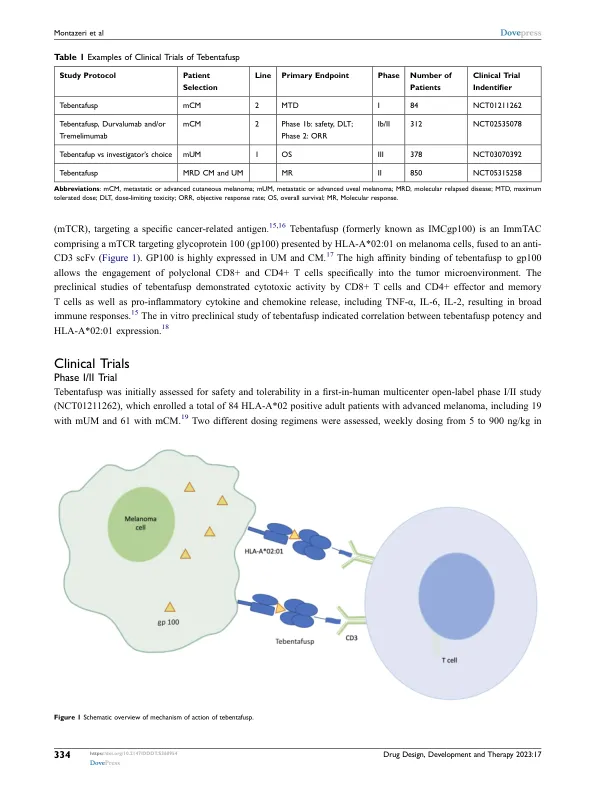
与 CM 不同,检查点免疫疗法 (CPI) 对转移性 UM (mUM) 的疗效中等,反应率不到 20%,中位总生存期 (OS) 率长达 19 个月。8、9 由于这些肿瘤中不存在 BRAF 突变,因此尚无批准的 UM 靶向疗法。10 几项测试 MEK 抑制剂司美替尼单独或与化疗联合使用活性的试验均未显示在 mUM 中有任何显着益处。11–13 尽管 GNAQ 和 GNA11 突变在 UM 中患病率很高,但尚无针对这些突变的获批治疗方法。2022 年 1 月,tebentafusp 是一种双特异性抗体,可与黑色素瘤细胞上的糖蛋白 100 (gp100) 结合 T 细胞,获得美国食品药品监督管理局 (FDA) 批准用于治疗 HLA-A*02:01 阳性的不可切除或转移性 UM (mUM)。 14 2022 年 4 月,欧洲药品管理局 (EMA) 批准 tebentafusp 用于相同适应症。Tebentafusp 是首个获得 FDA 批准用于癌症治疗的基于 T 细胞受体 (TCR) 的治疗药物,也是首个获得 FDA 批准用于治疗 mUM 的药物。在本综述中,我们总结了评估 tebentafusp 在不可切除或 mUM 患者中的疗效和安全性的临床数据(表 1)。此外,我们还讨论了患者选择标准以及相关的限制和挑战。
Tebentafusp 治疗转移性葡萄膜黑色素瘤
主要关键词