机构名称:
¥ 2.0
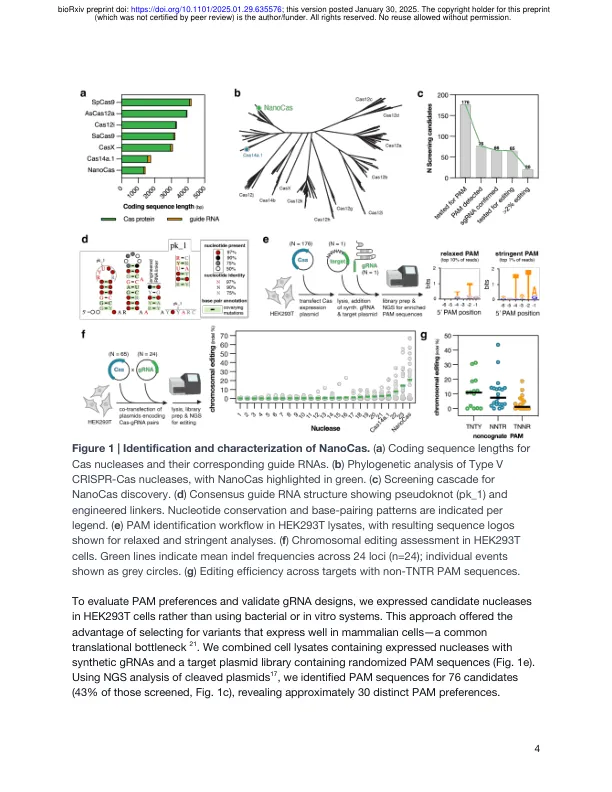
CRISPR 基因编辑是一种治疗遗传疾病的变革性技术,但递送限制在很大程度上限制了其治疗应用到肝脏靶向和体外治疗。在这里,我们介绍了 NanoCas 的发现和工程设计,这是一种超紧凑型 CRISPR 核酸酶,能够将 CRISPR 在体内的作用范围扩展到肝脏靶标之外。我们通过实验筛选了在宏基因组数据中发现的 176 个超紧凑型 CRISPR 系统,并应用蛋白质工程方法来提高 NanoCas 的编辑效率。当通过腺相关病毒 (AAV) 载体给药时,优化的 NanoCas 在体内对各种细胞系统和组织表现出强大的编辑能力。尽管 NanoCas 的大小约为传统 CRISPR 核酸酶的三分之一,但仍能实现这一点。在概念验证实验中,我们观察到在小鼠模型中使用优化的 NanoCas 进行稳健的编辑,该模型靶向参与胆固醇调节的基因 Pcsk9,并靶向肌营养不良蛋白中的外显子剪接位点以解决杜氏肌营养不良症 (DMD) 突变。我们进一步在非人类灵长类动物 (NHP) 体内测试了我们的 NanoCas 系统的有效性,结果发现肌肉组织中的编辑水平超过 30%。NanoCas 体积小巧,结合强大的核酸酶编辑功能,为体内非肝脏组织的单 AAV 编辑打开了大门,包括使用较新的编辑模式,例如逆转录酶 (RT) 编辑、碱基编辑和表观遗传编辑。
单 AAV CRISPR 编辑非...的骨骼肌
主要关键词