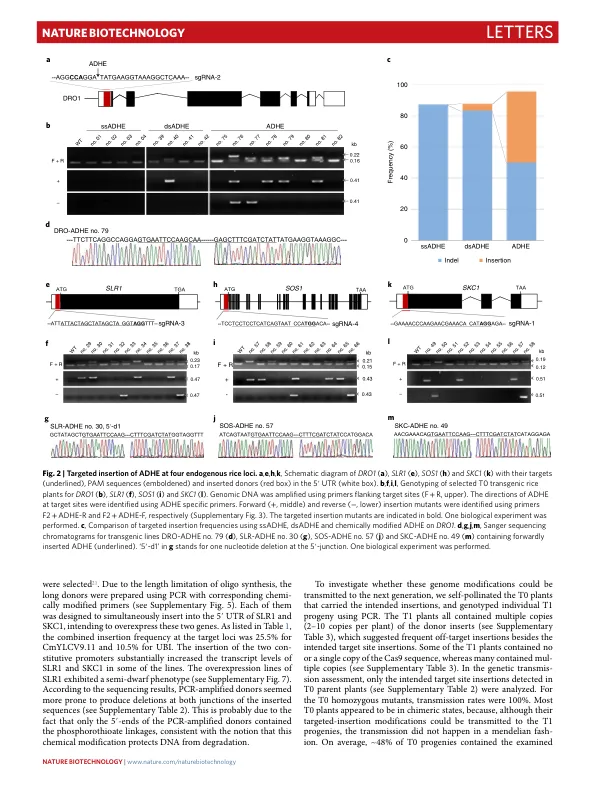
CRISPR–Cas9 方法已被用于在植物中产生随机插入和缺失、大量缺失、短序列的靶向插入或替换以及精确的碱基变化 1 – 7 。然而,用于功能基因组学研究和作物性状改良所需的长序列和基因的靶向插入或替换的通用方法很少,并且很大程度上取决于选择标记的使用 8 – 11 。基于在哺乳动物细胞中开发的方法 12 ,我们利用化学修饰的供体 DNA 和 CRISPR–Cas9 将长达 2,049 个碱基对 (bp) 的序列(包括增强子和启动子)插入水稻基因组,效率为 25%。我们还报道了一种依赖于同源性定向修复、化学修饰的供体 DNA 和目标位点串联重复序列的基因替换方法,以 6.1% 的效率实现了长达 130 bp 的序列的替换。在哺乳动物细胞中,使用平端的、5'-磷酸化的双链寡脱氧核苷酸 (dsODN),在两条 DNA 链的 5' 和 3' 端带有两个硫代磷酸酯键,可导致寡脱氧核苷酸 12 的强有力靶向整合。硫代磷酸酯键修饰旨在稳定细胞中的寡核苷酸,而 5'-磷酸化可促进非同源末端连接 (NHEJ),这是修复双链断裂 (DSB) 的主要途径,尤其是在培养细胞中。在用于再生小植株的培养植物细胞中,例如水稻愈伤组织细胞,NHEJ 也是主要的 DSB 修复途径 10,13。因此,这种类型的修饰 dsODN 可能会提高植物细胞中靶向插入的效率。为了验证这一假设,从水稻ADH1(酒精脱氢酶1)14 的5′非翻译区(UTR)中取出一个60bp的翻译增强子(ADHE)作为供体DNA,插入水稻的主要耐盐基因座SKC1(补充表1)15。如图1a所示,体外合成的ADHE供体DNA两侧有两个带有硫代磷酸酯键和5′-磷酸化修饰的核苷酸(ADHE;见补充图1b)。为了与传统供体DNA进行比较,还合成了未修饰的单链和双链寡脱氧核苷酸(ssADHE和dsADHE),带有三核苷酸多态性以供检测(图1b和补充图1b)。设计了一个针对 5 ʹ UTR 的单向导 RNA (sgRNA) (sgRNA-1),并将其构建到 CRISPR–Cas9 载体 pCBSG032 中(图 1c 和补充图 1a)。将三个供体 DNA 寡核苷酸按等摩尔比例混合,然后通过粒子轰击法将其与 CRISPR–Cas9 质粒 DNA (sgRNA-1) 一起引入中花 11 (ZH11) 水稻愈伤组织中。
水稻中靶向、高效的序列插入和替换
主要关键词




















![[双击插入图片]](/simg/2/2ddf968233451ab56ddf109ee29d8b2b6c752b27.webp)