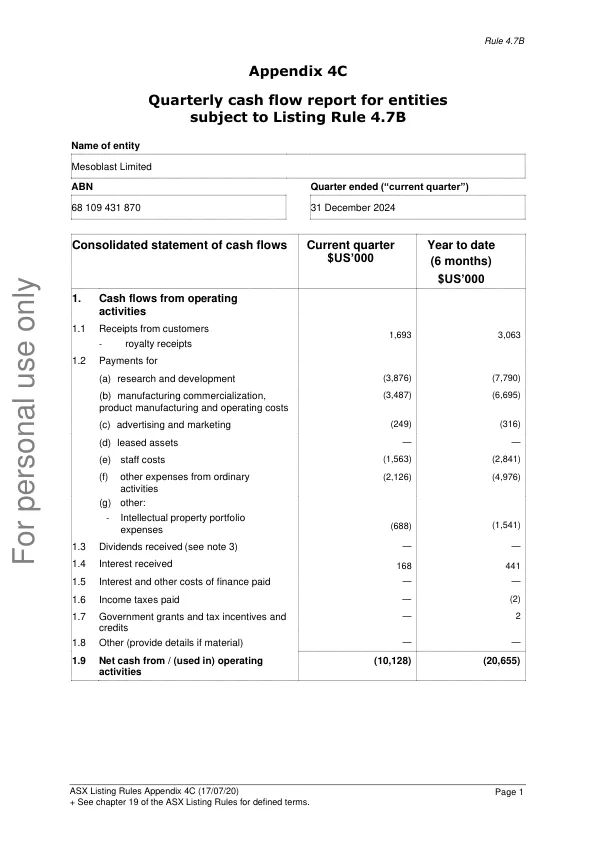
非执行董事的费用为 295,803 美元,非执行董事的咨询费为 80,602 美元,全职执行董事的工资为 231,552 美元,详见本季度附录 4C 现金流量报告第 6 项。2 本季度,我们的非执行董事收到了自 2023 年 8 月 1 日起欠付的董事费用的 50%,该费用的支付被延期,但须经 FDA 批准。从 2023 年 8 月到 2025 年 7 月,我们的非执行董事和执行董事(我们的首席执行官和首席医疗官)分别自愿将其费用的现金支付减少 50%,基本工资减少 30%,以代替接受股权激励。附件为附录 4C - 2025 财年第二季度季度现金流量报告的副本。关于 Mesoblast Mesoblast(该公司)是开发同种异体(现成)细胞药物的全球领导者,该药物用于治疗严重和危及生命的炎症疾病。该公司专有的间充质谱系细胞治疗技术平台的疗法通过释放抗炎因子来应对严重炎症,这些因子可以对抗和调节免疫系统的多个效应臂,从而显着减少破坏性的炎症过程。Mesoblast 的 RYONCIL®(remestemcel-L)用于治疗 2 个月及以上儿童的类固醇难治性急性移植物抗宿主病 (SR-aGvHD),是首个获得 FDA 批准的间充质基质细胞 (MSC) 疗法。请参阅完整的处方信息,网址为 www.ryoncil.com。Mesoblast 致力于基于其 remestemcel-L 和 rexlemestrocel-L 同种异体基质细胞技术平台开发针对不同适应症的其他细胞疗法。 RYONCIL 正在开发用于治疗其他炎症性疾病,包括成人 SR-aGvHD 和生物耐药性炎症性肠病。Rexlemestrocel-L 正在开发用于治疗心力衰竭和慢性腰痛。该公司已在日本、欧洲和中国建立了商业合作伙伴关系。关于 Mesoblast 知识产权:Mesoblast 拥有强大而广泛的全球知识产权组合,拥有 1,000 多项已授予的专利或专利申请,涵盖间充质基质细胞的物质组成、制造方法和适应症。这些已授予的专利和专利申请在所有主要市场提供至少到 2041 年的商业保护。关于 Mesoblast 制造:该公司的专有制造工艺可生产工业规模、冷冻保存、现成的细胞药物。这些细胞疗法具有明确的药物释放标准,计划随时提供给全球患者。Mesoblast 在澳大利亚、美国和新加坡设有办事处,并在澳大利亚证券交易所 (MSB) 和纳斯达克 (MESO) 上市。欲了解更多信息,请访问:www.mesoblast.com。LinkedIn: Mesoblast Limited 和 Twitter: @Mesoblast 参考文献/脚注 1. Perin EC. Et al. 间充质前体细胞可降低缺血性心脏病的死亡率和主要发病率
仅供个人使用
主要关键词