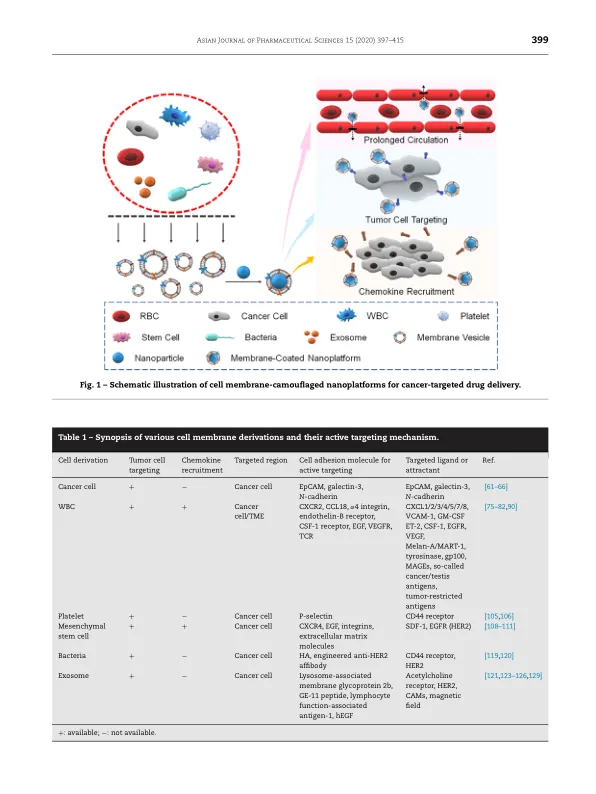
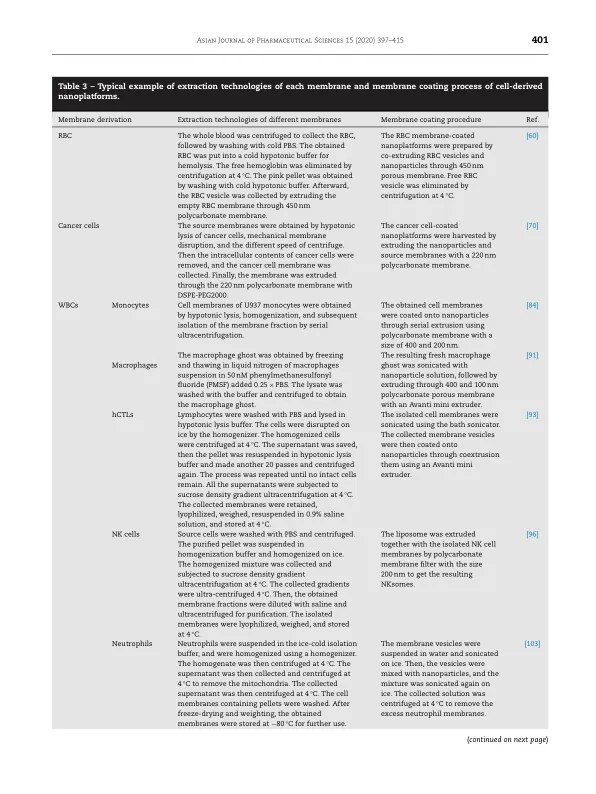
缺点仍然存在。近几十年来,出现了几种治疗癌症的替代方法。其中最成功的例子是免疫疗法,它已被许多现行癌症治疗指南推荐 [2]。然而,随着其在临床上的广泛应用,一些问题也随之出现。它们包括免疫疗法相关的副作用和相对较低的治疗效率 [3–5]。此外,一个令人困惑的问题是部分患者(但不是全部)对免疫疗法敏感。另一种新兴的治疗方法是光疗法,它在抗癌研究中非常流行,并已被证明可有效抑制癌症 [6 , 7]。然而,光疗法也有局限性。例如,只有表层肿瘤才能用光疗法治疗。此外,光热转变效率低下,需要进一步修改传统的光敏剂,以使光疗法得到更广泛的应用。随着纳米技术的进步和纳米医学研究力度的不断加大,基于纳米粒子的抗肿瘤溶液被认为是一种更好的治疗选择 [8 , 9]。为了提高抗癌效率,人们发明并合理设计了各种纳米载体,包括胶束、脂质体、纳米凝胶、纳米胶囊、纳米乳液、纳米复合物和其他设计[10–22]。其中一些纳米制剂已用于临床抗癌治疗[23–26]。通常,各种纳米载体作为药物载体给药,其功能是将负载在纳米载体中或化学结合到表面的各种抗癌剂运送到肿瘤[27–30]。某些类型的纳米药物由于其物理和化学特性也能够抑制肿瘤[27 , 31]。各种类型纳米药物的主要治疗能力依赖于它们在肿瘤部位的局部积累,而靶向特异性仍然是一个挑战。纳米载体在其他主要器官和健康细胞中的非特异性分布总会削弱治疗效果并导致严重的全身副作用。许多正在进行的研究的目标是开发策略来增强各种纳米药物在肿瘤内的积累,无论是被动的还是主动的。由于肿瘤血管的异常渗漏和不良的淋巴引流,增强的渗透性和滞留性 (EPR) 效应被动地促进了纳米颗粒在目标区域的局部积累 [32–34] 。然而,由于大多数基于纳米粒子的药物递送系统都是人工合成的,受体生物体能够准确、有效地识别“非自身”纳米粒子。因此,这些纳米材料会通过网状内皮系统迅速被清除[35,36]。因此,适当的修饰可以提高生物相容性并延长循环半衰期,从而增强EPR效应,从而改善各种纳米粒子的被动积累。使用聚乙二醇(PEG)修饰纳米粒子的生物界面曾被认为是提高纳米粒子生物相容性和循环半衰期的有效方法。然而,重复施用PEG修饰的纳米载体已被证明会刺激抗PEG抗体的分泌并诱导针对
用于癌症靶向药物输送的生物界面工程纳米平台
主要关键词