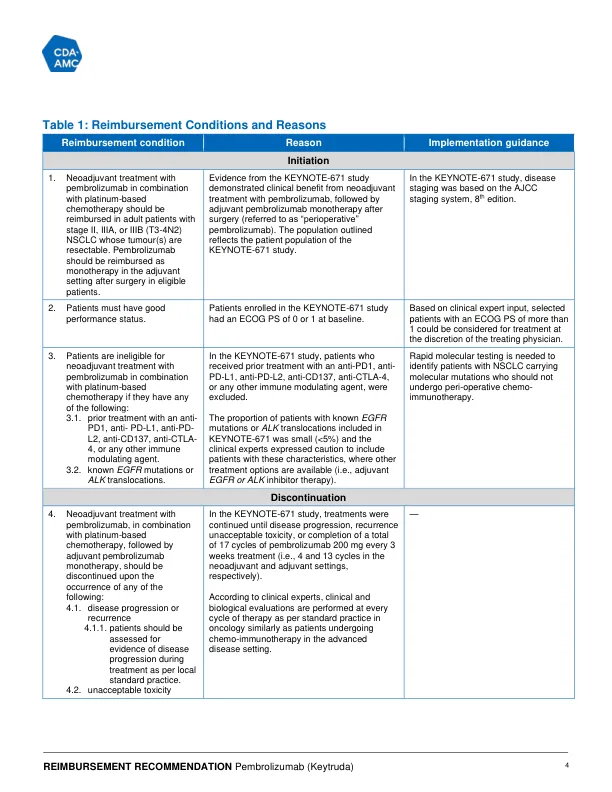
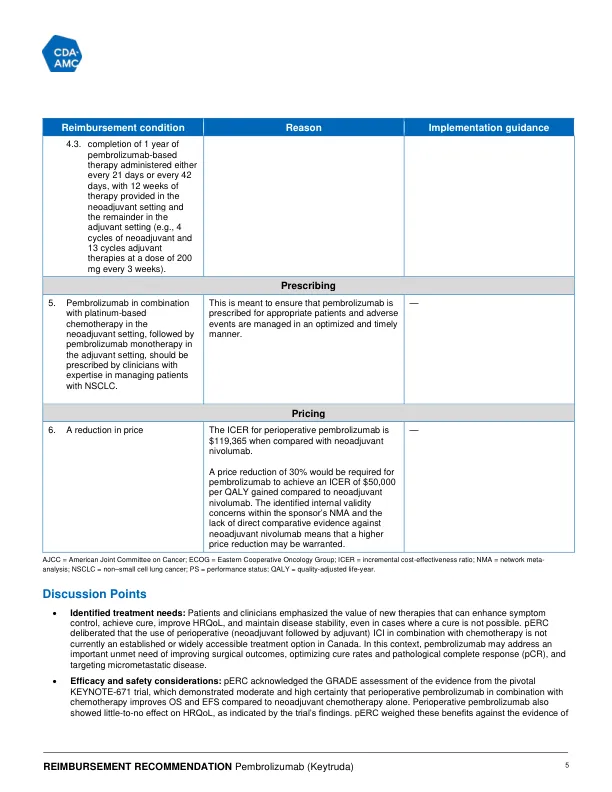
Evidence from 1 randomized, phase III, placebo-controlled trial (KEYNOTE-671, N = 797) in adult patients with resectable stage II, IIIA, or selected stage IIIB (T3-4N2) NSCLC demonstrated that pembrolizumab in combination with platinum-based chemotherapy as neoadjuvant treatment followed by pembrolizumab monotherapy as adjuvant treatment (referred to as与安慰剂(以铂金化的化学疗法为新辅助治疗)相比,本文中的围手术期pembrolizumab治疗在总体生存期(OS)和无事件生存期(EFS)上带来了有意义的临床益处,然后在辅助设置中进行安慰剂。与安慰剂组相比,该研究表明,危险比(HR)为0.72(95%置信区间[CI]:0.56至0.93; P = 0.00517)的中值OS的改善,与安慰剂组相比。Kaplan-Meier(KM)估计在36和48个月生存的概率的组间差异为|||| ||| ||| ||| || ||||| ||||| ||| ||| ||| || |||||与安慰剂组相比,有利于Pembrolizumab组。这项研究表明,HR为0.59(95%CI:0.48至0.72; P <0.00001)的中位数EFS有所改善,有利于Pembrolizumab组。在36周和48周时,EFS概率的km估计群体间差异为||||| ||| ||| ||| || ||||| ||||| ||| ||| ||| || |||||与安慰剂组相比,有利于Pembrolizumab组。pembrolizumab的不良效应曲线是可以管理的,并且与免疫检查点抑制剂(ICI)的已知副作用一致。通过全球健康状况/QOL评分评估,随着时间的推移,超过一半的患者报告了与健康相关的生活质量(HRQOL)的稳定或改善,其比例略高,略高于安慰剂组的pembrolizumab组(58.7%versbo)(58.7%vers 51.8%vers 51.8%;之间差异为51.8%;之间的差异; 7.0%之间,7.0%[95%ci:0.1.0.1.10.1:0.1.1.10.1:13.9]。
报销建议
主要关键词