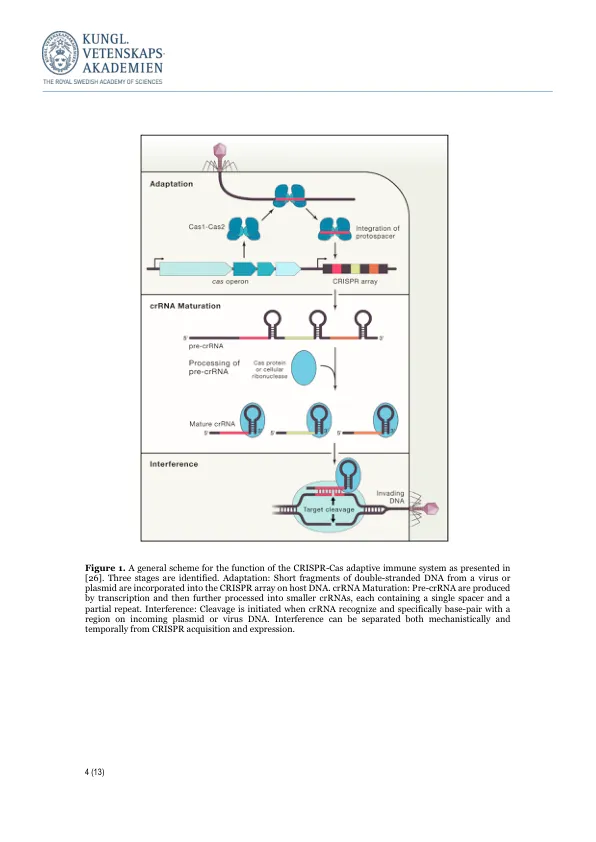
瑞典皇家科学院决定将 2020 年诺贝尔化学奖授予 Emmanuelle Charpentier 和 Jennifer A. Doudna,以表彰他们开发了一种基因组编辑方法。引言 1953 年,JD Watson 和 FHC Crick 报告了 DNA 的分子结构 [1]。从那时起,科学家们就一直试图开发能够操纵细胞和生物遗传物质的技术。随着 RNA 引导的 CRISPR-Cas9 系统的发现,一种简单有效的基因组工程方法现已成为现实。这项技术的发展使科学家能够修改各种细胞和生物中的 DNA 序列。基因组操作不再是实验的瓶颈。如今,CRISPR-Cas9 技术被广泛应用于基础科学、生物技术和未来治疗学的开发 [2]。在原核生物中发现 CRISPR-Cas 系统。最终导致发现用于基因组编辑的强大的 CRISPR-Cas9 系统的工作始于鉴定细菌和古菌中存在的重复基因组结构。 1987 年,一份报告指出大肠杆菌基因组中存在一个不寻常的重复结构,该结构包含五个高度同源的 29 个碱基对 (bp) 序列,包括 14 bp 的二元对称序列,其间散布着 32 bp 的可变间隔序列 [3]。几年后,在嗜盐古菌 Haloferax mediterranei 的基因组中也发现了类似的重复结构,其中有 14 个几乎完全保守的 30 bp 序列,以规律的距离重复 [4]。后续的生物信息学分析表明,这些类型的重复在原核生物中很常见,且都具有相同的特殊特征:一个短的部分回文元素成簇出现,并被独特的恒定长度的中间序列隔开,这表明其起源于祖先并具有高度的生物学相关性 [5]。从此引入了术语 CRISPR,这是成簇的规律间隔的短回文重复序列的缩写 [6]。了解 CRISPR 功能的重要一步是鉴定出 CRISPR 相关 (cas) 基因,这是一组仅存在于含有 CRISPR 的原核生物中且始终位于 CRISPR 相邻位置的基因。鉴定出的 cas 基因编码的蛋白质具有解旋酶和核酸酶基序,表明其在 DNA 代谢或基因表达中发挥作用 [6]。与 CRISPR 的关联被用作定义特征,在接下来的几年中,描述了许多 Cas 蛋白亚家族 [7, 8]。CRISPR 位点的功能重要性一直难以捉摸,直到 2005 年,研究人员注意到独特的 CRISPR 序列来自可传播的遗传元件,例如噬菌体和质粒 [9-11]。携带这些特定序列的原核生物似乎可以免受感染,因为含有与间隔序列匹配的序列(称为原间隔序列)的质粒或病毒通常不存在于携带间隔序列的原核生物中 [9, 11]。这些相关发现表明 CRISPR 在原核生物防御入侵外来 DNA 方面发挥着作用,间隔序列被描述为“过去‘遗传攻击’的记忆” [10]。已经证明 CRISPR 转录成长 RNA
基因组编辑工具
主要关键词