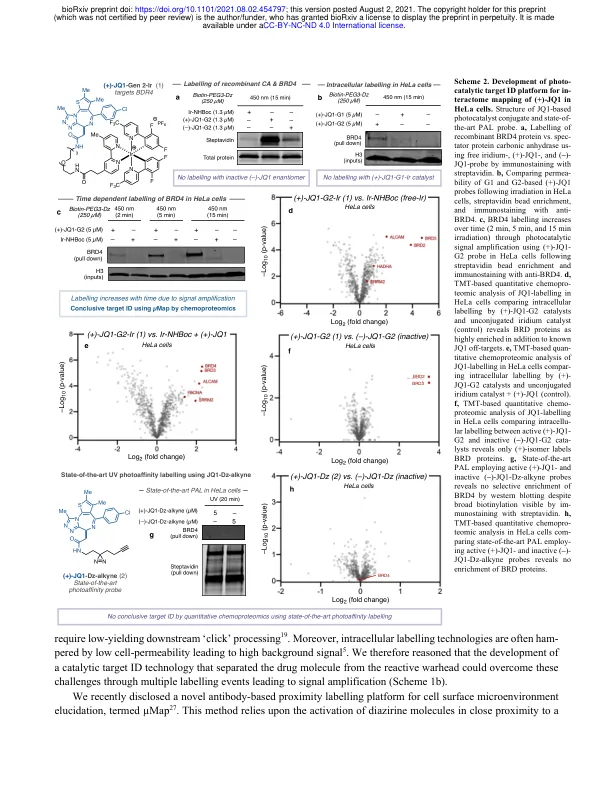
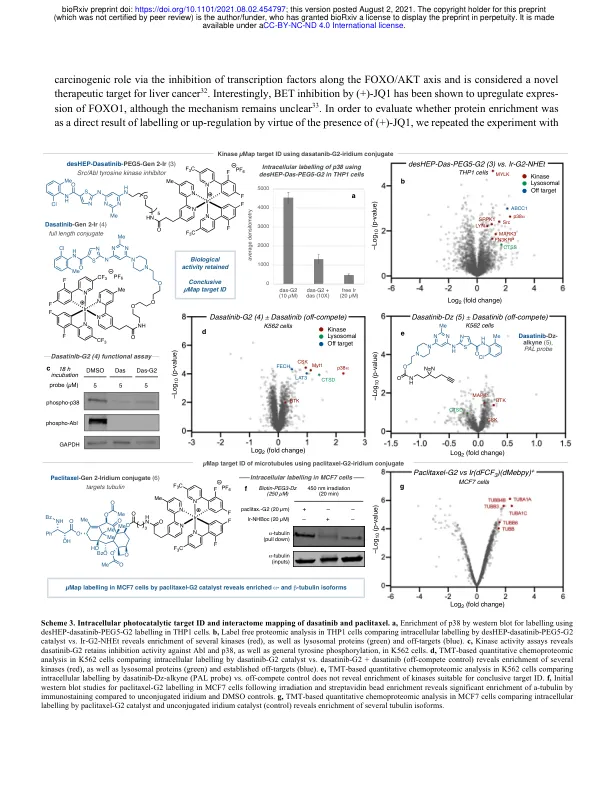
识别可用于治疗的细胞靶标(广义上称为靶标识别)仍然是药物发现的基本目标。近年来,加速靶标识别的新型化学和生物技术的应用已成为药物发现计划中的常见现象,因为全面了解分子在细胞环境中的反应方式可以提高结合选择性、改善安全性和临床疗效。使用光亲和标记 (PAL) 的既定方法通常成本高昂且耗时,因为信噪比差,再加上探针优化繁琐。在处理低丰度膜蛋白或多蛋白靶标结合时,此类挑战会加剧,通常导致靶标识别不可行。在此,我们描述了一种用于光催化小分子靶标识别的通用平台,该平台取决于通过可见光介导的 Dexter 能量转移产生高能卡宾中间体。通过将反应弹头与药物分离,催化信号放大可导致每种药物发生多次标记事件,从而实现前所未有的靶标富集水平。通过开发可穿透细胞的光催化剂结合物,该方法能够定量识别多种药物的靶标和脱靶,包括(+)-JQ1、紫杉醇和达沙替尼。此外,该方法还能够识别两种 GPCR(ADORA2A 和 GPR40)的靶标,这是一类在小分子 PAL 活动中很少成功发现的药物靶标。正文:识别生物靶标并了解它们在分子水平上的相互作用(靶标 ID)对于成功设计新的候选药物及其进入临床至关重要 1,2 。然而,近年来,全面表征药物靶标所面临的内在挑战表现为成功率低和时间长,导致整个行业的开发流程出现瓶颈 3,4 。因此,开发阐明小分子靶点的新方法有可能显著提高治疗靶点选择的成功率,从而减少临床流失,最终降低患者发病率(方案 1a)1,5,6 。在过去的二十年里,质谱 7 、化学遗传学 8 和生物信息学 9 等领域的技术进步改变了药物靶点识别,从而提高了我们对生物途径和细胞信号传导的理解 2,10 。然而,虽然这些信息为复杂的药物发现过程提供了更有针对性的途径,但对没有明确作用机制的蛋白质的靶点识别技术的需求仍然存在 11 。为了满足这一需求,基于亲和力的方法 12 ,尤其是光亲和标记(PAL),现已成为药物研发中常用的工具(方案 1a)13 。PAL 的工作原理是将化学计量的光活化基团(例如二氮丙啶)和亲和手柄(例如生物素)掺入小分子结构 14 。经过紫外线活化和基于亲和力的富集后,可以使用免疫印迹和蛋白质组学分析来收集有关目标蛋白质身份的信息 15 。
小分子光催化可实现药物靶标识别
主要关键词