机构名称:
¥ 1.0
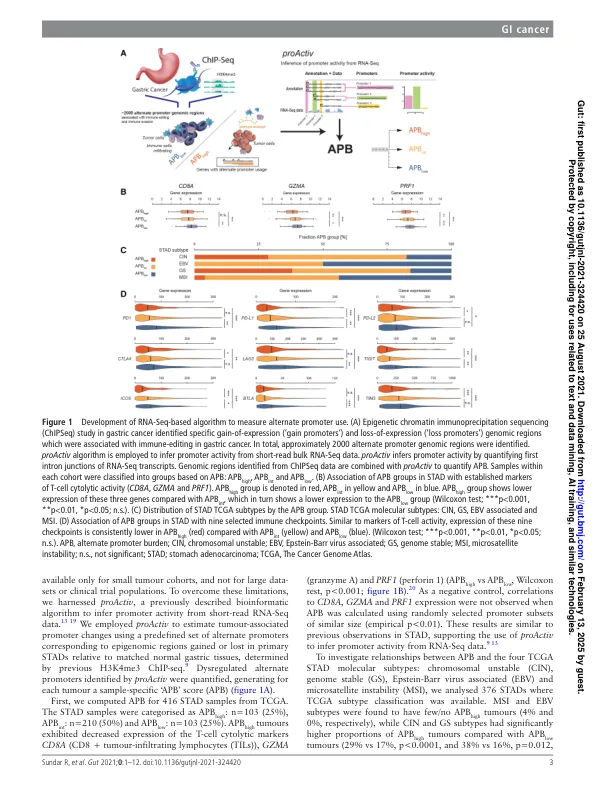
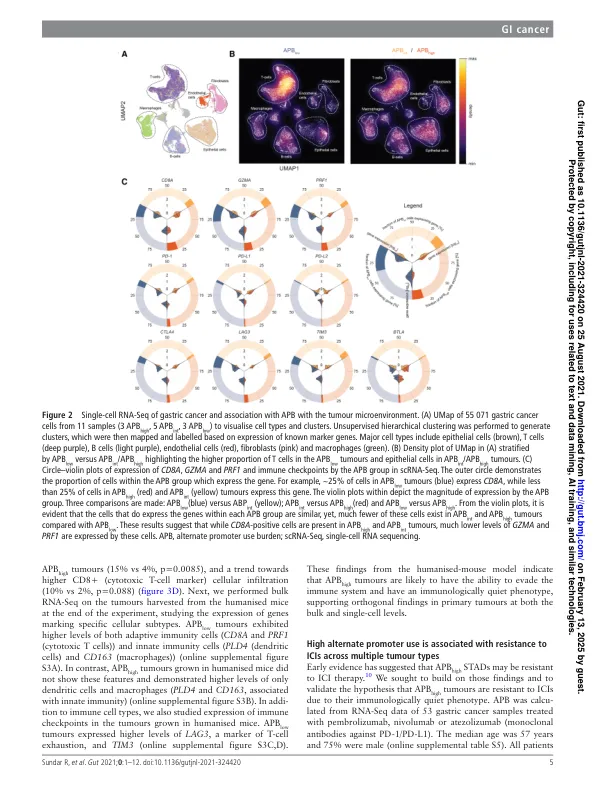
摘要 目的 癌症的表观基因组改变与免疫微环境相互作用,决定肿瘤的发展和治疗反应。我们旨在研究胃癌中表观遗传替代启动子使用对肿瘤免疫微环境的调节,并将我们的研究结果扩展到其他胃肠道肿瘤。设计 使用一种新颖的生物信息学算法 (proActiv) 量化替代启动子负荷 (APB),以从短读 RNA 测序和分为 APB 高、APB int 和 APB 低的样本推断启动子活性。进行单细胞 RNA 测序以分析肿瘤内免疫微环境。人源化小鼠癌症体内模型用于探索肿瘤动力学、替代启动子使用和人体免疫系统之间的动态时间相互作用。评估了接受免疫疗法治疗的多组胃肠道肿瘤,以确定 APB 与治疗结果之间的相关性。结果 APB high 胃癌肿瘤表达的 T 细胞溶细胞活性水平降低,并表现出免疫耗竭的特征。单细胞 RNA 测序分析证实了 APB high 肿瘤中不同的免疫群体和较低的 T 细胞比例。使用具有活跃人类免疫系统的“人源化小鼠”进行的功能性体内研究揭示了 APB 与肿瘤生长之间的明显时间关系,其中 APB high 肿瘤几乎没有人类 T 细胞浸润。对接受免疫疗法治疗的胃肠道癌患者的分析证实了 APB high 肿瘤对免疫检查点抑制的耐药性。与 APB low 相比,APB high 胃癌的无进展生存期明显较差(中位数 55 天 vs 121 天,HR 0.40,95% CI 0.18 至 0.93,p=0.032)。结论这些发现表明替代启动子的使用与肿瘤微环境之间存在关联,从而导致免疫逃避和免疫疗法耐药性。
胃肠道肿瘤免疫中的表观遗传启动子改变
主要关键词