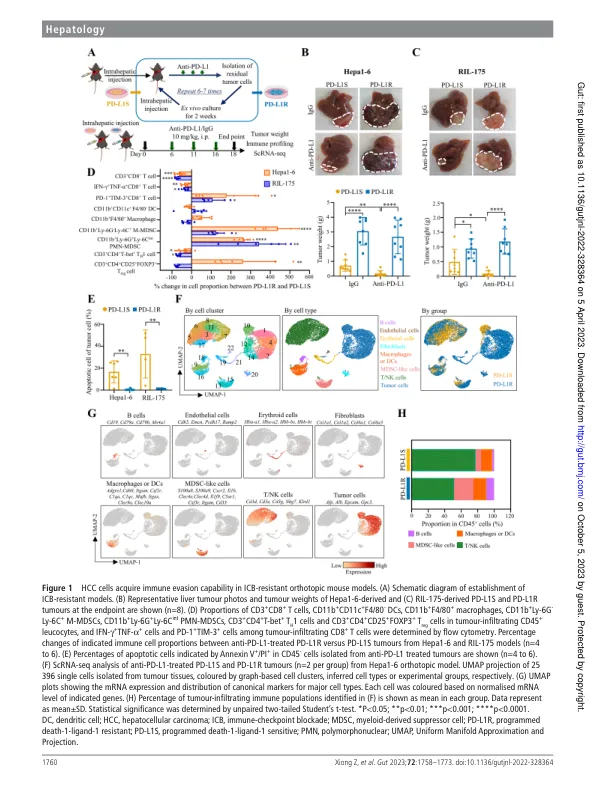
抽象客观治疗诱导的肿瘤微环境(TME)重塑为癌症治疗带来了一个主要障碍。作为大多数肝细胞癌(HCC)患者表现出对反编程细胞死亡(配体)-1(抗PD- [L] 1)疗法的原发性或获得性的抗性,我们旨在研究对免疫接收靶标进行肿瘤适应的基础机制。设计通过抗PD-L1治疗的合成元素,免疫能力小鼠对HCC细胞的串行原位植入产生了两种抗免疫疗法的HCC模型,并通过单细胞RNA测序(SCRNA-SEQ),基因组和免疫分析对单细胞RNA测序(SCRNA-SEQ)进行询问。通过慢病毒介导的敲低和药理学抑制研究了关键信号通路,并通过对Pembrolizumab(NCT03419481)的II期试验进行了对HCC肿瘤活检的SCRNA-SEQ分析进一步验证。在没有明显的遗传变化的情况下,抗PD-L1耐药性肿瘤在免疫能力但不受免疫功能障碍的小鼠中比父母肿瘤大10倍,而这些小鼠的肿瘤变化伴随着髓样衍生的抑制细胞(MDSC)的肿瘤内积累(MDSC),cytotoxic cd8 + T细胞的细胞毒素和DESBORISECONS。从机械上讲,过氧化物酶体增殖物激活的受体伽马(PPARγ)转录活化活化的血管内皮生长因子-A(VEGF-A)产生以驱动MDSC扩张和CD8 + T细胞功能障碍的转录激活的血管内皮生长因子-A(VEGF-A)的产生。选择性的PPARγ拮抗剂触发了原位和自发性HCC模型中的免疫抑制至刺激性TME转化率,并将肿瘤变成抗PD-L1治疗。重要的是,对pembrolizumab抗性的HCC患者有40%(6/15)表现出肿瘤的PPARγ诱导。此外,较高的基线PPARγ表达与多种癌症类型的1例治疗患者的抗PD-(L)生存率较差有关。结论我们发现了一个适应性转录程序,肿瘤细胞通过PPARγ /VEGF-A介导的靶向免疫检查点靶向< /div < /div < /div
靶向PPAR -GAMMA抵消适应...
主要关键词